汽车的发明与使用,是人类智慧的杰出体现,它为人们的生活和生产带来了极大的方便,同时由此引发的环境污染问题也越来越引起人们的关注。
(1)汽车排放的尾气中因含有氮的氧化物而污染大气,造成产生氮的氧化物的主要原因是( )
A.燃烧含氮化合物燃料引起的
B.燃烧含铅汽油引起的
C.是由于汽油燃烧不充分引起的
D.是汽缸中的N2被氧化生成的
(2)下列有关城市各项污染源与其造成的恶果对应关系正确的是( )
A.汽车尾气—光化学烟雾;工业废气—酸雨;工业废水—“公害病”
B.汽车尾气—酸雨;工业废气—“公害病”;工业废水—光化学烟雾
C.汽车尾气—“公害病”;工业废气—酸雨;工业废水—光化学烟雾
D.汽车尾气—光化学烟雾;工业废气—“公害病”;工业废水—酸雨
(3)一氧化氮和一氧化碳都是汽车尾气里的有害物质,它们能缓慢地发生如下反应:2NO(g)+2CO(g)= N2(g)+2CO2(g) ΔH<0。现利用此反应,拟设计一种环保装置以消除汽车尾气对大气的污染。下列设计方案可以提高尾气处理效果的是________。
①选用适当的催化剂 ②提高装置的温度
③降低装置的压强 ④在装置中装入碱石灰
A.①③ B.②④ C.①④ D.②③
(4)新型环保出租车采用LPG+汽油的双燃料系统,其尾气中的有毒气体成分较普通车型下降80%左右,缓解了汽车尾气排放给城市环境造成的污染问题。下列物质中不属于上述有害气体的是________。
A.CO2和H2 B.NO2和NO
C.CO和SO2 D.C粒和含铅化合物
(5)所谓“绿色汽车”是指使用液化石油气等无污染或污染较小的能源作燃料的汽车。绿色汽车可避免有毒的铅、苯的同系物以及稠环芳烃的排放。燃烧等质量的液化石油气(主要成分是含C3~C4的烃)与汽油相比较________。
A.前者生成的水少
B.前者消耗氧气量少
C.前者燃烧产生的热量多
D.前者产生的含碳化合物种类少
(6)为了减少大气污染,许多城市推广汽车使用清洁燃料。目前使用的清洁燃料主要有两类:一类是压缩天然气,另一类是液化石油气。这两类燃料的主要成分都是________。
A.碳水化合物 B.碳氢化合物
C.氢气 D.醇类
(18分)下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
(1)地壳中含量居于第二位的元素在周期表中的位置是________________。
(2)②、⑦的最高价含氧酸的酸性是由强到弱的,用原子结构解释原因:
__________,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的离子化合物,写出其中一种化合物的电子式_______________。
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,下列物质不能做该反应催化剂的是(填序号)________。
a.MnO2 b.CuSO4 c.Na2SO3d.FeCl3
(5) W与④是相邻的同主族元素。在下表中列出H2WO3的各种不同化学性质,举例并写出相应的化学方程式。
| 编号 |
性质 |
化学方程式 |
| 示例 |
氧化性 |
H2WO3+3H3PO3===3H3PO4+H2W↑ |
| 1 |
||
| 2 |
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
X溶液与Y溶液反应的离子方程式______________,
N→⑥的单质的化学方程式为____________,
M溶液中离子浓度由大到小的排列顺序是______________ ,
M中阳离子的鉴定方法 __________。
在2L密闭容器中,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
⑴写出该反应的平衡常数表达式:K=__________________________
已知:K(300℃)>K(350℃),该反应是________热反应。
⑵右图中表示NO2的变化的曲线是____________。用O2表示从0~2s内该反应的平均速率v=__________________
⑶能说明该反应已经达到平衡状态的是___________
a、v(NO2)=2v(O2) b、容器内压强保持不变
c、v逆(NO)=2v正(O2) d、容器内的密度保持不变
⑷为使该反应的反应速率增大,且平衡向正反应方向移动的是__________
a、及时分离出NO2气体 b、适当升高温度
c、增大O2的浓度 d、选择高效的催化剂
实验室需要0.1 mol·L-1NaOH溶液450 moL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
⑴如图所示的仪器中配制溶液肯定不需要的是(填序号);配制上述溶液还需用到的玻璃仪器是(填仪器名称)。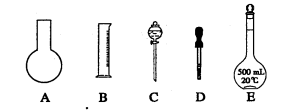
⑵下列操作中,容量瓶所不具备的功能有(填序号)。
| A.配制一定体积准确浓度的标准溶液 |
| B.贮存溶液 |
| C.测量容量瓶规格以下的任意体积的液体 |
| D.准确稀释某一浓度的溶液 |
E.用来加热溶解固体溶质
⑶请计算需用托盘天平称取固体NaOH的质量为g。某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图.由图中可以看出,烧杯的实际质量为g。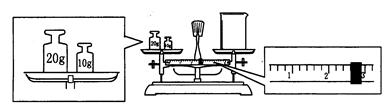
⑷根据以上计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为mL(计算结果保留一位小数)。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是。
设水的电离平衡曲线如图所示: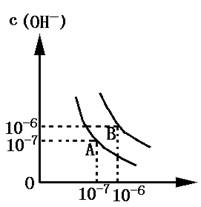
⑴若以A点表示水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点,则此时水的离子积从增加到.
⑵将pH=8的Ba(OH)2溶液与PH=5的稀盐酸相混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2与盐酸的体积比为
同素异形体相互转化的反应热相当少而且转化速率较慢,有时还很不完全,测定反应热很困难,现在可根据盖斯定律进行计算。
已知:P4(固体.白磷)+5O2(气体)= P4O10(固体) △H=-2983.2kJ·mol-1 ①
P(固体.红磷)+O2(气体)=P4O10(固体) △H=-738.5kJ·mol-1 ②
⑴由热化学方程式来看,更稳定的磷的同素异形体是
⑵试写出白磷转化为红磷的热化学方程式