为了测定某纯碱样品中碳酸钠的质量分数,取该样品与足量稀盐酸在烧杯中反应,有关实验数据如下表。
| |
反应前 |
反应后 |
|
| 实验数据 |
烧杯和稀盐酸的质量 |
纯碱样品的质量/g |
烧杯和其中混合物的质量/g |
| 120 |
12 |
127.6 |
|
请计算:(1)该反应生成二氧化碳的质量为 g。
(2)该纯碱样品中碳酸钠的质量分数为多少。(请写出计算过程)
选用下列物质填空:①氖气 ②氮气③过氧化氢溶液 ;④氢气⑤氧气 ⑥活性炭
(1)通常用作保护气和制取化肥的是_____;(2)常用于炼钢的是_____;
(3)能吸附一些有毒气体的物质是___;(4)医学上常用____来清洗创口和局部抗菌;(5)最清洁的燃料是___;(6)航标灯中充入的气体,在通电时会发出红光的是____;
(1)用化学用语表示:
① 2个氮分子;②保持水的化学性质的最小微粒;
③ 氢氧根离子;④氯化氢中氯元素的化合价为-1价。
(2)写出下列物质的化学式或名称:
| 化学名称 |
① |
氖气 |
③ |
硝酸铵 |
| 化学式 |
SiO2 |
② |
FeSO4 |
④ |
小刚收集到一瓶浑浊的太湖水,他要模拟自来水厂的净水过程,最终制成蒸馏水。其实验过程如下所示。请回答以下问题。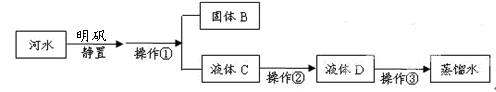
(1)操作①的名称是。
(2)操作②向滤液C中加入_________,利用其吸附性除去水样中的颜色和异味。此过程主要发生变化(填“物理”、“化学”)。
(3)小刚取少量液体D于试管中,加入少量肥皂水,振荡,发现有较多泡沫出现,说明液体D是(填“硬水”、“软水”)。
(4)消毒剂高铁酸钠(化学式为Na2FeO4)集氧化、凝聚、杀菌等功能于一体,目前被广泛应用于自来水净化。高铁酸钠中铁元素的化合价为。
小峰和几位同学在实验室用下列装置制取几种气体。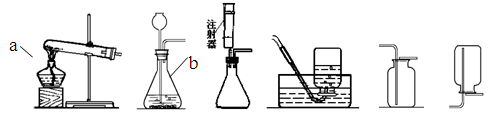
A B C D E F
⑴写出图中标有a的仪器名称。
⑵小峰想用高锰酸钾制取较纯净的氧气,他应选择上述装置中A和(填字母)进行组装。你认为A装置需作的改进是,作用是。该反应的文字或符号表达式为。
⑶若小华选用B装置作为制氧气的发生装置,则他应选择的药品名称是,经观察,小华认为选用C装置更好,请你说出选用C装置的优点。
⑷小梅通过查阅资料得知:实验室用块状石灰石和稀盐酸反应制取二氧化碳,已知二氧化碳的密度比空气大且能溶于水;实验室制取二氧化碳应选择的装置组合是。(填字母)
(1)化学就在我们身边,化学与我们的生活息息相关。从氮气、二氧化碳、稀有气体、明矾四种物质中选出与下列用途相对应的物质,填写在空白处:
(1)①充入食品包装袋可以防腐的气体单质是;
②可做净水剂的是______;
③充入灯管可以做霓虹灯的是__________;
④植物光合作用不可缺少的气体是_____。
(2)用数字和化学符号填空:
①3个钠原子;
②2个氮分子;
③4个氢氧根离子;
④氧化镁中镁显+2价;
⑤碳酸钠。