已知木炭还原氧化铜实验中发生的主要反应:C+2CuO 2Cu+CO2↑.化学兴趣小组对该实验产物(假设反应物已完全反应)作如下探究:
2Cu+CO2↑.化学兴趣小组对该实验产物(假设反应物已完全反应)作如下探究:
探究一:检验产物的成份
【提出问题】实验产物是暗红色固体,很难观察到紫红色固体.暗红色固体是什么?
【查阅资料】氧化亚铜(Cu2O)为红色固体;Cu2O+H2SO4═CuSO4+Cu+H2O.
【猜想与假设】暗红色固体除铜外还可能含有Cu2O.
【设计实验】取少量暗红色固体,加入稀硫酸,如果观察到现象: ,说明暗红色固体含有Cu2O.
探究二:测定产物中Cu2O的含量
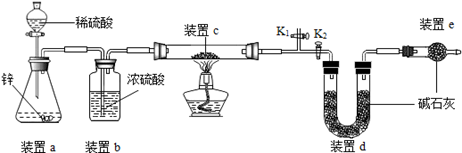
原理:Cu2O+H2 2Cu+H2O,称取一定质量的固体样品,用如图装置进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置d的质量达到实验目的.
2Cu+H2O,称取一定质量的固体样品,用如图装置进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置d的质量达到实验目的.
(1)装置a中用稀硫酸而不用稀盐酸,原因是 ;
(2)若不加装置e,实验结果会偏高,原因是 ;
(3)点燃酒精灯前涉及的部分操作如下,正确的顺序是 ;
①打开K2,关闭K1
②检查装置的气密性
③连接仪器
④关闭K2,打开K1,通氢气一段时间
(4)还可通过测定反应前后装置 (填“a”、“b”或“c”)的质量达到实验目的.
化学实验是学习化学的重要方法.请完成下列金属性质的实验
(1)实验一:比较铁、铜的金属活动性强弱,请你设计实验完成下表内容。
| 实验步骤 |
实验现象 |
结论 |
| 金属活动性:Fe>Cu |
(2)实验二:镁、锌、铁三种金属与酸的反应。
[实验]取一定量的镁、锌、铁三种金属分别加入到溶质质量分数相同的稀硫酸中,充分反应,观察现象。
[结论]活泼金属能与酸反应。
[分析]①三个反应的共同特点是 ,写出其中一个反应的化学方程式 。
②若完全反应后,三个反应生成氢气的质量相等,原因是 。
如图所示,取三根粗细、长度均相同的光亮细铁丝,将其中两根分别盘成螺旋状,在每根铁丝一端绑上粗铜丝,另一端系一火柴,点燃火柴,待快燃尽时,分别插入充满氧气的集气瓶中(预先放入一些水).观察到:I、II中铁丝都剧烈燃烧,且II中铁丝燃烧比I中的更剧烈;III中铁丝没有燃烧。
(1)为什么III中铁丝不能燃烧?
(2)分析II中铁丝燃烧比I中的更剧烈的原因。
如图是某同学设计的实验室制取二氧化碳并验证其性质的实验装置图.
请回答下列问题:
(1)将A、E装置连接时,应将A装置的导管a与E装置的导管 (选填“b”或“c”)相连接.检验E装置中二氧化碳已收集满的方法是 .
(2)将A、B装置连接,观察到的现象是 ,可验证二氧化碳的性质是 .
(3)将A、C装置连接,可验证二氧化碳与氢氧化钙反应,该反应的化学方程式为: .
(4)用E装置收集一瓶二氧化碳气体,取下双孔橡皮塞,将瓶中的气体沿D装置烧杯左侧内壁缓慢倒入,观察到的现象时 ,这些现象说明二氧化碳具有的物理性质 ,化学性质 , .
实验室内有一瓶化肥的标签已脱落,只知道它是NH4Cl、(NH4)2SO4和KNO3中的一种.现进行如下实验:
(1)取少量样品在研钵中与 混合研磨,有刺激性气味的气体放出.
(2)另取少量化肥样品与试管中,加入少量水溶解,再滴入图中的 溶液,产生白色沉淀.根据以上实验,可知该化肥为 .
硫酸铜晶体常用作农业和渔业的杀虫剂、杀菌剂,某同学设计了下列两条途径由废铜料(含铁)生产硫酸铜晶体,其过程如下所示: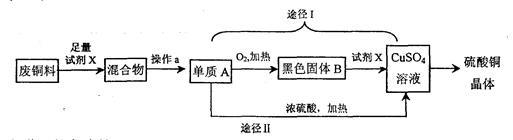
(1)操作a的名称是: ;
(2)已知:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O。则途径I与途径II相比,其优点体现在:
①不产生二氧化硫有毒气体,不会污染空气;② ;
(3)将废铜料投入硫酸铜溶液中充分搅拌,发生反应的化学方程式为: 。