常温下,对pH=10的NaHCO3溶液中,各微粒的物质的量浓度分析正确的是
| A.c(CO32—)>c(H2CO3) |
| B.c(Na+)>c(HCO3—)>c(OH―)>c(H+) |
| C.c(Na+)+c(H+)=c(HCO3—)+c(CO32—)+c(OH―) |
| D.c(Na+)=c(HCO3—)+c(CO32—)+c(H2CO3) |
下列各项实验操作正确的是
| A.使C2H5Br和NaOH溶液混合后水解,取上层清液,滴加AgNO3溶液检验溴元素 |
| B.为增强高锰酸钾溶液的氧化性,可用盐酸将高锰酸钾溶液酸化 |
| C.将苯与溴水混合后,再加铁粉,即可制得溴苯 |
| D.在蔗糖溶液中加入几滴稀硫酸,水浴加热5 min,加入NaOH溶液至碱性,再加入银氨溶液并水浴加热 |
某高聚物的片断结构为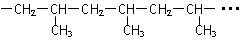 ,合成该高分子化合物的单体是
,合成该高分子化合物的单体是
| A.CH2=CH2 | B.CH2=CH-CH3 |
| C.CH3CH2CH3 | D.CH3CH(CH3)CH3 |
下列各项中的两种物质无论以何种比例混合,只要混合物的总物质的量一定,则完全燃烧时生成水的质量和消耗O2的质量均不变的是
| A.C3H6、C3H8O | B.C2H4、C2H6O |
| C.C2H2、C6H6 | D.CH4O、C2H4O3 |
下列烷烃的命名正确的是
| A.2,3-二甲基丁烷 | B.3,4-二甲基戊烷 |
| C.2-甲基-3-乙基丁烷 | D.2-乙基己烷 |
目前造成城市空气中铅污染的主要来源是
| A.煤的燃烧 | B.汽车废气 | C.垃圾燃烧 | D.废塑料燃烧 |