下列各组离子能在溶液中大量共存的是( )
| A.Na+、Mg2+、Cl-、OH- | B.H+、Ca2+、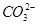 、 、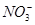 |
C.Cu2+、K+、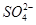 、 、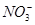 |
D.Na+、H+、OH-、Ca2+ |
下列变化不能用勒夏特列原理解释的是
| A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率 |
| B.合成氨工业中使用催化剂,以提高NH3的产量 |
| C.红棕色的NO2加压后颜色先变深再变浅 |
D.CO2(g) CO2(aq)ΔH<0,降温增压可增大二氧化碳气体在水中的溶解度 CO2(aq)ΔH<0,降温增压可增大二氧化碳气体在水中的溶解度 |
已知反应:①101kPa时,2C(s)+O2(g)=2CO(g) △H=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(1) △H=-57.3kJ/mol下列结论正确的是
| A.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量 |
| B.①的反应热为221kJ/mol |
| C.通过浓硫酸与稀NaOH溶液反应测得的中和热为57.3kJ/mol |
| D.碳的燃烧热的数值大于110.5kJ/mol |
下列对“改变反应条件,导致化学反应速率改变”的原因描述不正确的是
| A.增大反应物的浓度,活化分子百分数增加,反应速率加快 |
| B.增大气体反应的压强,单位体积中活化分子数增多,气体反应速率加快 |
| C.升高温度能使化学反应速率增大,主要原因是增加了活化分子的百分数,从而使有效碰撞频率提高 |
| D.催化剂通过改变反应路径,使反应所需的活化能降低,反应速率增大 |
下表中是各组反应的反应物和反应温度,反应刚开始时放出H2速率最快的是
| 编号 |
金属(粉末状) |
酸的浓度及体积 |
反应温度 |
| A |
Mg,0.1 mol |
6mol·L-1硝酸10mL |
60℃ |
| B |
Mg,0.1 mol |
3mol·L-1盐酸10mL |
60℃ |
| C |
Fe,0.1 mol |
3mol·L-1L盐酸10mL |
60℃ |
| D |
Mg,0.1 mol |
3mol·L-1硫酸10mL |
60℃ |
已知反应:(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) △H=+74.9kJ.mol-1,下列说法中正确的是
| A.该反应中熵变、焓变皆大于0 |
| B.该反应是吸热反应,因此一定不能自发进行 |
| C.在碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐的分解一定能自发进行 |
| D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应 |