ZnMnO2干电池应用广泛,其电解质溶液是ZnCl2NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)若ZnCl2NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是____________。
欲除去Cu2+,最好选用下列试剂中的________(填代号)。
| A.NaOH | B.Zn | C.Fe | D.NH3·H2O |
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是___________。若电解电路中通过2 mol电子,MnO2的理论产量为________g。
近年来,我国的电子工业迅速发展,造成了大量的电路板蚀刻废液的产生和排放.蚀刻液主要有酸性的(HCl-H2O2)、传统的FeCl3型(HCl-FeCl3)等方法。蚀刻废液中含有大量的Cu2+,废液的回收利用可减少铜资源的流失。几种蚀刻废液的常用处理方法如下:
(1)FeCl3型酸性废液用还原法处理是利用Fe和Cl2分别作为还原剂和氧化剂,可回收铜并使蚀刻液再生。发生的主要化学反应有:Fe+Cu2+=Fe2++Cu、Fe+2H+=Fe2++H2↑,还有__________、__________(用离子方程式表示).
(2)HCl-H2O2型蚀刻液在蚀刻电路板过程中发生的化学反应用化学方程式可表示为:______________。
(3)处理H2O2型酸性废液回收Cu2(OH)2CO3的过程中需控制反应的温度,当温度高于80℃时,产品颜色发暗,其原因可能是______________.
焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生的反应体系中共有六种物质: NH4Cl、FeCl3、N2、Fe2O3、Fe和X。
(1)根据题意,可判断出X是_________(写化学式)。
(2)写出并配平该反应的化学方程式,并标出电子转移的方向和数目:_________________;
(3)在反应:5S2O82-+2Mn2++8H2O=10SO42-+2MnO4-+16H+中,得电子的元素为__________________,5molS2O82-参加反应时转移电子物质的量为_____________。
T ℃、2L密闭容器中某一反应在不同时刻的各物质的量如图所示(E为固体,其余为气体)。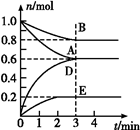
回答下列问题:
(1)写出该反应的化学方程式: 。
(2)反应开始至3 min时,用D表示的平均反应速率为 mol·L-1·min-1。
(3)T ℃时,该反应的化学平衡常数K= 。
(4)第6 min时,保持温度不变,将容器的体积缩小至原来的一半,重新达到平衡后,D的体积分数为 。
(5)另有一个2 L的密闭容器,T ℃、某一时刻时,容器中各物质的量如下表所示:
| 物质 |
A |
B |
D |
E |
| 物质的量(mol) |
0.8 |
1.0 |
0.4 |
0.2 |
此时v(正) v(逆)(填“>”或“﹦”或“﹤”)。
已知某浓度的硫酸在水中的电离方程式:
H2SO4=H++HSO4-,HSO4- H++ SO42-。
H++ SO42-。
(1)Na2SO4溶液显__________(填“酸性”“碱性”或“中性”),理由是(用离子方程式表示)_________。
(2)在25 ℃时0.1 mol·L-1的NaHSO4溶液中c(SO42-)="0.029" mol ·L-1,则25 ℃时,0.1 mol·L-1 H2SO4溶液中c(SO42-)_________0.029 mol ·L-1(填“大于”,“小于”或“等于”),理由是 。
(3)在0.1 mol ·L-1 Na2SO4溶液中,下列粒子浓度关系正确的是 。
| A.c(Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-) |
| B.2c(Na+)=c(SO42-)+c(HSO4-) |
| C.c(Na+)>c(SO42-)>c(H+)>c(OH-) |
| D.c(SO42-)+c(HSO4-)=0.1 mol·L-1 |
钠、镁、铁、铜及其化合物在科研和生产生活中有广泛的应用。
(1)Mg—H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,结构如图所示。电池工作时,正极的电极反应式 。常温下,用该电池电解200mL的饱和硫酸铜溶液(电极为惰性电极),反应时溶液中水的电离平衡 移动(填“向左”“向右”或“不”);当消耗24mg金属Mg,电解后溶液的pH= (不考虑溶液的体积变化)。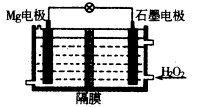
(2)利用电解法在铁制品上镀铜可以防止铁被腐蚀,以下说法正确的是 。
a.电镀时,铜和石墨都可以做阳极,可溶性铜盐作电解质溶液
b.电镀过程中,温度升高,电解反应速率加快
c.电镀过程中,电能全部转化为化学能
d.电镀过程中,铜离子向阴极移动,发生还原反应