X、Y、Z、W、Q是五种短周期元素,它们在周期表中的位置如图。下列说法不正确的是
| X |
|
||||
| |
|
|
Y |
Z |
W |
| Q |
|
|
|
|
|
A.Z与W可形成的化合物在5种以上
B.Z、W、Q三种元素形成的化合物,其水溶液一定呈中性
C.X、Y、Z、W形成的化合物的化学式可以是Y2X7W2Z
D.X与Y、Z、W均可形成原子个数比为2:1的化合物
右图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的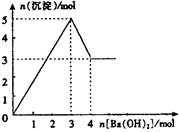 物质的量随Ba(OH)2的物质的量的变化关系。该
物质的量随Ba(OH)2的物质的量的变化关系。该
溶液的成分可能是
| A.MgSO4 | B.KAl(SO4)2 |
| C.Al2(SO4)3 | D.NaAlO2 |
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O +O2+xOH—
+O2+xOH—Fe3O4+S4O +2H2O,下列说法中,正确的是:
+2H2O,下列说法中,正确的是:
| A.每生成1mol Fe3O4,反应转移的电子总数为3mol | B.Fe2+和S2O 都是还原剂 都是还原剂 |
| C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol | D.x=2 |
下列除去杂质的方法正确的是
A.除去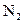 中的少量 中的少量 :通过灼热的CuO粉末,收集气体 :通过灼热的CuO粉末,收集气体 |
B.除去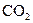 中的少量HCl:通入 中的少量HCl:通入 溶液,收集气体 溶液,收集气体 |
C.除去 溶液中的少量 溶液中的少量 :加入足量铁屑,充分反应后,过滤 :加入足量铁屑,充分反应后,过滤 |
D.除去KCl溶液中的少量 :加入适量NaOH溶液,过滤 :加入适量NaOH溶液,过滤 |
下列离子方程式,正确的是
| A.Ca(ClO)2溶液中通入少量SO2气体: H2O +SO2 + Ca2+ + 2ClO— ="==" CaSO3↓+ 2HClO |
| B.向NH4HCO3 溶液中加入足量Ba(OH)2溶液 NH4+ +HCO3— + 2OH— ="==" H2O + CO32—+ NH3·H2O |
| C.向FeCl2溶液中加足量溴水 2Fe2+ + Br2 ="==" 2Fe3++ 2Br— |
| D.NaAlO2溶液中通入过量CO2 |
2AlO2— +CO2+3H2O===2Al(OH)3↓+CO32—
下列对有关实验的描述不正确的是
A.在浓氨水中加入生石灰可以制取少量的NH3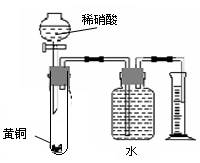 |
B.用水就可以一次性鉴别溴苯、苯、乙酸三种物质 |
| C.用如图所示的装置可以测定黄铜(Cu、Zn合金)中Zn的含量 | |
| D.除去粗盐中的Ca2+、Mg2+、SO42-,依次加入的物质可以是 |
H2O、 Ba(OH)2、Na2CO3、HCl