【化学选修-化学与技术】(15分)铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作______________剂。
(2)自然界中Cr主要以+3价和+6价存在。+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬。写出过程中的离子方程式: 。
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是 。
(4)NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下: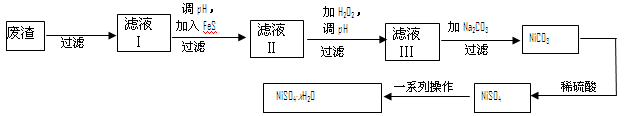
①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为 。
②对滤液Ⅱ先加H2O2再调pH,加H2O2的目的是 ,调pH的目的是 。
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是 。
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。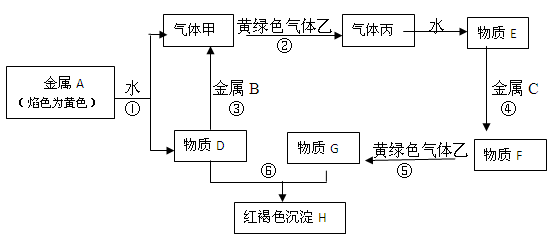
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A、B、C
甲、乙、H
(2)写出下列反应的离子方程式:
反应⑤
反应⑥
(12分)配平下列各氧化还原反应方程式(将系数填写在相应横线上,并按要求填空)
⑴ ___ KMnO4+ ___ HCl =" _____" MnCl2+ _____ KCl + ____ Cl2 ↑ + ___ H2O
⑵_____ HNO3 = ___NO2 ↑ + _____ O2 ↑+ _____H2O
配平如下反应方程式并标注电子转移的方向和数目
⑶_____Na +____Cu2+ + ____H2O ==______Na+ + ____Cu(OH)2 ↓ + ____H2 ↑
该反应的氧化剂是;若转移的电子数是1mol,得到H2mol
A、B、C、D、E五种短周期元素。A元素所处的周期数、主族序数、原子序数均相等;B元素原子的半径是其所在主族中最小的,其最高价氧化物对应水化物的化学式为HBO3;C元素原子最外层上的电子数为内层电子数的2倍;元素D的二价阴离子与E的阳离子的核外电子排布相同;E元素的周期数比族序数多2。请回答:
(1) 写出元素的符号:A; B____________。
(2)画出D离子的结构示意图________________________,
C在周期表的位置为;
(3)C的最高价氧化物的电子式是;
E与D的单质在常温下反应的生成物电子式为,E与D按原子数1∶1化合而成的物质所含化学键类型为。
(4) A与D可形成三种电子总数为10的微粒,其中形成分子的结构式为,写出另二种微粒其中一种的化学式; A与D还可形成电子总数为18的微粒,该微粒的化学式为。
(9分 ) (1)已知在 2L的容器中进行下列可逆反应,各物质的有关数据如下:
aA (g)+ bB (g)  2C(g)
2C(g)
起始物质的量(mol): 3 2 0
2s末物质的量浓度(mol/L): 0.9 0.8 0.4
则① a =,b =;
② 2S内B的反应速率=。
(2) 1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO
反应的热化学方程式。
下列各组物质中: ③H2O和 D2O
③H2O和 D2O
④ CH3CH3和CH3CH2CH2CH3⑤ CH3-CH2-OH和CH3-O-CH3
互为同位素的是;;互为同素异形体是:;
互为同分异构体是:;互为同系物的是___。