选做(12分)【化学一物质结构与性质】原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。
请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布式为_________,第一电离能最小的元素是__________(填元素符号)。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是________(填化学式)。
(3)B元素可形成多种单质。一种晶体结构如图一所示,其原子轨道的杂化类型为________。另一种的晶胞如图二所示,若此晶胞中的棱长为356.6pm,则此晶胞的密度为_________g·cm-3(保留两位有效数字)。(已知: )
)
(4)D的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是________(填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到首先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液。请写出沉淀溶解的离子方程式:_________________。
完成下列有机反应的化学方程式
(1)CH≡CH+HCN→
(2)CH3CH2CH2CHO+HCN→
(3)  +CH3CH2Cl→
+CH3CH2Cl→
(4)CH3CH2CH=CH2+Cl2
(5)CH3CH2CH2CH2Cl+H2O
(6) CH3CH2CH2CH2Cl
25℃时,0.1 mol·L-1的某酸HA溶液中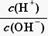 =1010,请回答下列问题:
=1010,请回答下列问题:
(1)HA是酸(填“强”或“弱”),写出其电离方程式。
(2)在加水稀释HA的过程中,随着水量的增加而减小的是________(填字母)。
A.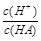 |
B. |
C.c(H+)·c(OH-) | D.c(OH-) |
(3)已知100℃时水的离子积是1.0×10—12,在此温度下,有pH=3的盐酸和pH=3的HA的两种溶液
①取等体积两溶液,分别稀释到pH=4时,两者加水量的关系是:前者________后者(填>、<或=,下同);
②取等体积的两溶液,分别加入等物质的量的相应钠盐固体少量,两溶液的pH大小关系是:前者________后者;
③50mL pH=3的盐酸溶液和50mL 0.003mol/LNaOH溶液混合后溶液的pH=_____________.
④pH=3的HA溶液中由水电离出的c(H+)=mol/L
(4)如何通过化学实验来证明HA是弱酸还是强酸,请写出其中的一种化学实验方法:
。
在某一容积为5 L的密闭容器内,加入0.3 mol的CO和0.3 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g) 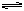 CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如右图:
CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如右图:
(1)根据图上数据,反应开始至达到平衡时,
CO的化学反应速率为v(CO)=mol/(L·min)-1,
该温度下的平衡常数K=。
(2)在体积不变的条件下,改变下列条件重新达到平衡时能使平衡常数K增大的有
(填字母)
| A.升高温度 | B.降低温度 | C.增大压强 | D.减小压强 |
E.加入催化剂 G.移出一氧化碳气体
(3)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.2 mol的CO2和0.2 mol的H2,在相同的条件下,反应达平衡时,c(CO)=________________mol/L.
(4)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol 的水蒸气,重新达到平衡后,CO的转化率_______(填“升高”、“降低”还是“不变”),CO2的质量分数________(填“升高”、“降低”还是“不变”).
(5)在催化剂存在和800℃的条件下,在某一时刻测得C(CO)=C(H2O)= 0.09mol/L,
C(CO2 )=C(H2)=0.13mol/L ,则此反应是否处于平衡状态:(填“是”或“否”),若没有处于平衡状态则该反应向移动。(填“正方向”或“逆方向”)
现有以下物质:①NaCl晶体,②SO3,③冰醋酸,④铁丝,⑤BaSO4晶体,
⑥蔗糖,⑦乙醇,⑧熔融KNO3,请回答下列问题(填序号):
(1)以上物质中能导电的是;
(2)以上物质中属于非电解质,但其水溶液可以导电的是;
(3)以上物质中属于弱电解质的是;
按要求写出下列方程式
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式是:
(2)已知在25℃、101kPa时,CO的燃烧热为283kJ/mol,相同条件下,若2molCH4完全燃烧生成液态水,所放出的热量为1molCO完全燃烧放出热量的6.3倍,CH4完全燃烧反应的热化学方程式是:
(3)Al(OH)3的电离反应方程式:
(4)H2S的电离反应方程式:
(5)NaHSO4溶于水的电离方程式