向甲、乙、丙三个密闭容器中充入一定量的X和Y,发生反应:x(g)+aY(g) 2Z(g)。各容器的反应温度、反应物起始量,反应过程中Z的浓度随时间变化关系分别以下图和下表表示。下列说法不正确的是
2Z(g)。各容器的反应温度、反应物起始量,反应过程中Z的浓度随时间变化关系分别以下图和下表表示。下列说法不正确的是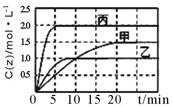
| 容器 |
甲 |
乙 |
丙 |
| 容积 |
0.5L |
0.5L |
1.0L |
| 温度/℃ |
T1 |
T2 |
T2 |
| 反应物 起始量 |
1.0molX 0.5molY |
1.0molX 0.5molY |
4.0molX 2.0molY |
A.该反应温度升高,平衡常数减小
B.20min内甲容器中反应的平均速率: v(X) = 0.075mol·(L·min)-1
C.其他条件不变,若缩小乙的体积,Y的转化率不变
D.10min时,其他条件不变,向乙容器中再加入2 molZ,平衡向逆反应方向移动
元素周期表中某区域的一些元素多用于制造半导体材料,它们是
| A.左下方区域的金属元素 |
| B.右上方区域的非金属元素 |
| C.金属元素和非金属元素分界线附近的元素 |
| D.稀有气体元素 |
下列化学用语的书写,正确的是
A.氮气的电子式: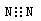 |
B.硫原子的结构示意图: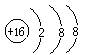 |
C.溴化钠的电子式: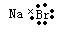 |
D.水分子的结构式: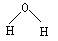 |
煤、石油、天然气是人类使用的主要能源,同时也是重要的化工原料,下列不属于以煤、石油和天然气为主要原料生产的合成材料是
| A.塑料 | B.合成橡胶 | C.淀粉 | D.合成纤维 |
中小学生经常使用的修正液中往往含有某种易挥发的有毒溶剂,应尽量减少或避免使用,这种溶剂可能是下列物质中的
| A.乙醇 | B.二氯乙烯 | C.乙酸 | D.水 |
下列实验的失败是因为缺少必要的实验步骤造成的是
①将乙醇和乙酸混合,再加入稀硫酸供热制乙酸乙酯
②将在酒精灯火焰上灼烧至表面变黑的Cu丝冷却后插入乙醇中,Cu丝表面仍是黑色
③要除去甲烷中混有乙烯得到干燥纯净的甲烷,将甲烷和乙烯的混合气体通过溴水
④做葡萄糖的还原性实验时,当加入新制的氢氧化铜碱性悬浊溶液后,未出现红色沉淀
⑤检验淀粉已经水解,将淀粉与少量稀硫酸加热一段时间后,加入银氨溶液后未析出银镜
| A.①④⑤ | B.①③④⑤ | C.③④⑤ | D.④⑤ |