下列关于元素周期表和元素周期律的说法中正确的是
| A.在周期表中,元素的族序数都等于其原子的最外层电子数 |
| B.周期表中非金属性最强的元素,其最高价氧化物的水化物酸性也最强 |
| C.同主族元素随原子核电荷数的递增,原子半径依次减小 |
| D.第ⅦA族元素的单质,随分子量的增大,熔、沸点逐渐升高 |
能正确表示下列反应的离子方程式是
| A.CuCl2溶液中加入少量氨水:Cu2++2OH-=Cu(OH)2↓ |
| B.向酸性KMnO4溶液中通入SO2:3SO2+2MnO4-+4OH-=2MnO2↓+3SO42-+2H2O |
C.电解饱和MgCl2溶液:2Cl-+2H2O 2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑ |
| D.向Na2SO3溶液中滴加足量NaClO溶液:SO32-+ ClO-= SO42-+ Cl- |
用下列实验装置进行相应实验,装置正确且能达到实验目的的是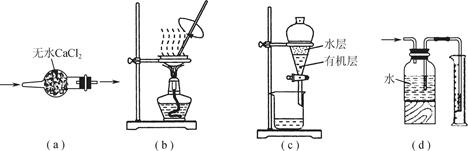
| A.用图a所示装置干燥SO2气体 |
| B.用图b所示装置蒸发CH3COONa溶液得醋酸钠晶体 |
| C.用图c所示装置分离有机层与水层,水层从分液漏斗下口放出 |
| D.用图d所示装置测量氨气的体积 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.0.1mol·L-1 NaHCO3溶液:K+、AlO2-、Cl-、NO3- |
| B.使甲基橙变红色的溶液:NH4+、Cu2+、ClO-、Na+ |
| C.c(H+)=1×10-13 mol∙L-1的溶液中:Mg2+、Cu2+、SO42-、NO3- |
| D.遇苯酚变紫色的溶液:Na+、Mg2+、SO42-、Cl- |
下列有关物质的性质和该性质的应用均正确的是
| A.浓硫酸具有吸水性,可用于干燥氨气、二氧化碳等气体 |
| B.二氧化硫具有漂白性,可用于加工食品使食品增白 |
| C.铝具有良好的导电性,钢抗拉强度大,钢芯铝绞线可用作远距离高压输电线材料 |
| D.铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸 |
化学科学需要借助化学专用语言描述,下列有关化学用语正确的是
| A.HClO的结构式:H-O-Cl |
B.Na2O2的电子式: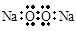 |
C.中子数为20的氯原子: |
D.聚丙烯的结构简式: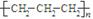 |