下表是元素周期表的一部分,回答下列有关问题: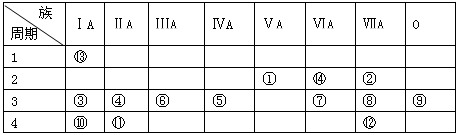
(1)写出下列元素符号:① ________,⑤ ________,⑦ ________。
(2)画出原子的结构示意图:④________,⑥ ________,⑧________。
(3)在这些元素中,最活泼的金属元素是________,最活泼的非金属元素是________,最不活泼的元素是________。
(4)在这些元素的最高价氧化物对应水化物中,酸性最强的是________,碱性最强的是________,呈两性的氢氧化物是________。
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
X溶液与Y溶液反应的离子方程式为___________________________________,
N→⑥的单质的化学方程式为______________________________________________,
(6)在③与④中,化学性质较活泼的是________,怎样用化学实验证明?
答:____________________________________________________________;
在⑧与⑫中,化学性质较活泼的是________,请用化学方程式来说明。
答:___________________________________________________________。
苯乙烯(C6H5CH=CH2)是生产各种塑料的重要单体,其制备原理是:
C6H5C2H5(g) C6H5CH=CH2(g)+H2 (g) △H=+125kJ·mol-1
C6H5CH=CH2(g)+H2 (g) △H=+125kJ·mol-1
(1)该反应的平衡常数表达式为K= __ _____________。随着温度的升高,K值________(填“增大”、“减小”或“不变”,下同)。
(2)实际生产中常以高温水蒸气作为反应体系的稀释剂(稀释剂不参加反应)。C6H5C2H5的平衡转化率与水蒸气的用量、体系总压强关系如下图。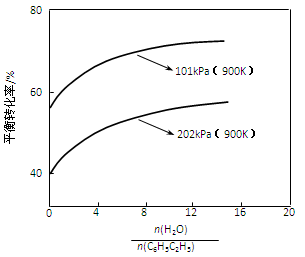
①由上图可得出:
结论一:其他条件不变,水蒸气的用量越大,平衡转化率越______;
结论二:__________________________________________________。
②加入稀释剂能影响C6H5C2H5平衡转化率的原因是:_______________________。
(3)某些工艺中,在反应的中途加入O2和特定的催化剂,有利于提高C6H5C2H5的平衡转化率。试解释其原因:_______________________________________________。
(16分)(1)反应A(g)+B(s) C(g);△H<0,在其他条件不变时,改变其中一个条件,则生成C的速率:
C(g);△H<0,在其他条件不变时,改变其中一个条件,则生成C的速率:
①升温____________;②增大压强____________;③增大容器容积____________;
④加入A____________;⑤加入B____________;⑥加正催化剂____________。
(2)在25℃、101kPa下,1g甲烷燃烧生成CO2和液态水时放热55.6kJ。则表示甲烷燃烧热的热化学方程式为___________________________________________。
(3)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6),丙烷脱氢可得丙烯。
已知:C3H8(g)=CH4(g)+HC CH(g)+H2(g)△H1="+156.6" kJ·mol-1
CH(g)+H2(g)△H1="+156.6" kJ·mol-1
CH3CH CH2(g)= CH4(g)+HC
CH2(g)= CH4(g)+HC CH(g )△H2="+32.4" kJ·mol-1
CH(g )△H2="+32.4" kJ·mol-1
则相同条件下,反应C3H8(g)=CH3CH CH2(g)+H2(g) 的△H=kJ·mol-1。
CH2(g)+H2(g) 的△H=kJ·mol-1。
(4)下表中的数据表示破坏1 mol化学键需消耗的能量(即键能,单位为kJ·mol-1):
| 化学键 |
C—H |
C—F |
H—F |
F—F |
| 键能 |
414 |
489 |
565 |
158 |
根据键能数据计算以下反应的反应热△H:
CH4(g)+4F2(g)﹦CF4(g)+4HF(g)△H=______________________
在一定条件下,可逆反应:mA+nB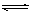 pC达到平衡,若:
pC达到平衡,若:
(1)A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的关系是。
(2)A、C是气体,增加B的量,平衡不移动,则B为态。
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是。
(4)加热后,可使C的质量增加,则正反应是反应(放热或吸热)。
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)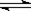 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=。
(2)该反应为反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为℃。
(1)有四种钠的化合物,根据下列反应式判断W、X、Y、Z的化学式。
W,X,Y,Z。
①W→X+CO2↑+H2O ②Z+CO2→X+O2
③Z+H2O→Y+O2↑ ④X+Ca(OH)2→Y+CaCO3↓
(2)A、B、C、D、E五种物质的焰色反应都显黄色。A、B与水反应都有气体产生,A与水反应放出的气体有氧化性,B与水反应放出的气体有还原性,同时都生成C的溶液。C与适量的CO2反应生成D,D的溶液与过量的CO2反应生成E的溶液,E加热又变为D。填写下列空白:
①B与水反应的化学方程式:。
②D的溶液与过量的CO2反应生成E的溶液反应的化学方程式:。