在25℃时,电解含有0.02 mol CuSO4和0.04 mol NaCl的混合溶液200mL,当阳极产生672mL(标准状况下)气体时,假设忽略溶液体积变化,则电解后溶液的PH为
| A.1 | B.2 | C.6 | D.7 |
关于下列各装置图的叙述不正确的是
| A.用图①装置精炼铜,a极为粗铜,电解质溶液为CuSO4溶液 |
| B.图②装置中盐桥中的Cl-移向乙烧杯 |
| C.图③装置中钢闸门可与外接电源的负极相连受到保护 |
| D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同 |
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表: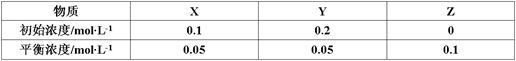
下列说法错误的是
| A.反应达到平衡时,X的转化率为50% |
B.反应可表示为X+3Y 2Z,其平衡常数为1600 2Z,其平衡常数为1600 |
| C.增大压强使平衡向生成Z的方向移动,平衡常数增大 |
| D.改变温度可以改变此反应的平衡常数 |
反应CO2 (g)+2NH3(g) CO(NH2)2(s)+H2 O(g)△H<O,达到平衡时,下列说法正确的是
CO(NH2)2(s)+H2 O(g)△H<O,达到平衡时,下列说法正确的是
| A.加入催化剂,平衡常数不变 |
| B.减小容器体积,正、逆反应速率均减小 |
| C.增大CO(NH2)2的量,CO2的转化率减小 |
| D.降低温度,平衡向逆反应方向移动 |
下列有关钢铁腐蚀和防护的说法不正确的是
| A.自行车的钢圈上镀一层铬,防止生锈 |
| B.外加直流电源保护钢闸门时,钢闸门与电源的负极相连 |
| C.钢铁发生吸氧腐蚀的正极反应:2H2O +O2+4e-=4OH- |
| D.钢铁发生析氢腐蚀的负极反应:Fe – 3e-=Fe3+ |
下列实验操作,对实验结果不会产生影响的是
| A.用酸碱中和滴定法测待测液浓度时,装标准液的滴定管用水洗后未用标准液润洗 |
| B.用酸碱中和滴定法测待测液浓度时,装待测液的锥形瓶用水洗后用待测液润洗2~3次 |
| C.测定中和反应的反应热时,将碱溶液缓慢倒入酸溶液中 |
| D.用蒸馏水湿润的pH试纸测定硫酸钠溶液的pH |