工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:
(1)气体A中的大气污染物可选用下列试剂中的 吸收。
A.浓H2SO4 B.稀HNO3 C.NaOH溶液 D.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在 (填离子符号),检验溶液中还存在Fe2+的方法是 (注明试剂.现象)。
(3)由泡铜冶炼粗铜的化学反应方程式为 。
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al.Zn.Ag.Pt.Au等杂质)的电解精炼,下列说法正确的是
A.电能全部转化为化学能
B.粗铜接电源正极,发生氧化反应
C.溶液中Cu2+向阳极移动
D.利用阳极泥可回收Ag、Pt、Au等金属
(5)利用反应可制备CuSO4,若将该反应2Cu2+ + O2 + 2H2SO4 = 2CuSO4 + 2H2O设计为原电池,其正极电极反应式为 。
(12分)Ⅰ试写出中学阶段常见的两种制取氧气的化学方程式:
;。
Ⅱ.实验室中通常用MnO2作催化剂分解过氧化氢,已知CuSO4溶液对过氧化氢的分解也具有催化作用,某实验兴趣小组同学猜想其他盐溶液也可能在这个反应中起同样的作用,于是他们做了以下探究。请你帮助他们完成实验报告:
(1)实验过程:在一支试管中加入5 mL 5%的H2O2溶液,然后滴入适量的FeCl3溶液,把带火星的木条伸入试管。
实验现象:。
实验结论:FeCl3溶液可以催化分解H2O2。
(2)已知FeCl3在水中可解离出Fe3+和Cl-,同学们提出以下猜想:
甲同学的猜想:真正催化分解H2O2的是FeCl3溶液中的H2O;
乙同学的猜想:真正催化分解H2O2的是FeCl3溶液中的Fe3+;
丙同学的猜想:真正催化分解H2O2的是FeCl3溶液中的Cl-。
你认为最不可能的是同学的猜想,理由是。
(3)同学们对余下的两个猜想,用实验进行了探究,并记录如下,请你仔细分析后填表:
实验过程实验现象结论
| 实验过程 |
实验现象 |
结论 |
| 向盛有5 mL 5%的H2O2溶液的试管中滴入少量的 HCl,把带火星的木条伸入试管. |
无明显现象 |
|
| 向盛有5 mL 5%的H2O2溶液的试管中滴入少量的Fe2(SO4)3,把带火星的木条伸入试管. |
试管中有大量气泡产生,带火星的木条复燃 |
已知某气态化石燃料X中只含有碳、氢两种元素,为探究该气体中碳和氢两种元素的质量比,某同学设计了燃烧法测量的实验方案,通过测量装置C和D的增重即可求得碳和氢两种元素的质量比。实验装置如图所示(已知CuO可以作为碳氢化合物燃烧的催化剂):
(1)若A装置中所盛放的药品是浓NaOH 溶液,写出装置A的一种作用:_
(2)C装置中所盛放的药品是:
(3)D装置中所盛放的药品是:
(4)E装置中所盛放的药品是:
(5)上述装置中有一处错误, (不考虑
酒精灯和加热方法可能存在的错误;
若增加仪器和药品,请指明仪器、药
品名称和位置):其改正方法是
(6) 若实验装置经过改正后,进行如下定量实验:准确称取7.2 g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,U形管C管质量增加10.8 g,广口瓶D质量增加22 g,则该有机物的最简式为
(7)若能确定其分子式,则其同分异构体中沸点最低物质的名称__ (习惯命名法)。
某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。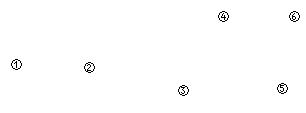
可选药品:浓硝酸、3mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液与NO不反应,能与NO2反应2NO2+2NaOH=NaNO3+ NaNO2+H2O
(1)实验应避免有害气体排放到空气中,装置③、⑥中盛放的药品依次是
(2)滴加浓硝酸之前的操作是检验装置的气密性,加入药品后,还应进行哪些操作
再滴加浓硝酸与铜反应。
(3)装置①中发生反应的化学方程式是
(4)装置②的作用是,发生反应的化学方程式是
(5)该小组得出的结论依据的实验现象是
海洋植物,如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海带中提取碘的流程如下: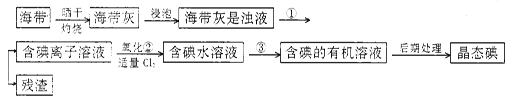
(1)指出提取碘的过程中有关的实验操作名称:
①;③______________________。
写出实验②中有关反应的离子方程式 _______________________。
(2)提取碘的过程中,可供选择的有关试剂是___________。
| A.甲苯,酒精 | B.四氯化碳,苯 |
| C.汽油,乙酸 | D.汽油,甘油 |

(3)从含碘的有机溶液中提取碘和回收有机溶剂还需经过蒸馏,指出上图实验装置中的错误之处:①②③。
(4)进行上述蒸馏操作时,使用水浴的原因是___________;最后,晶态碘在___________里聚集。
实验室合成乙酸乙酯的步骤如下:在园底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是________
(2)在烧瓶中加入一定比例的乙醇和浓硫酸的混合液的方法是:
(3)在该实验中,若用1mol乙醇和1mol 乙酸在浓硫酸作用下加热,充分反应,能否生成1mol乙酸乙酯?,原因是
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。图中圆括号内为适当的试剂,方括号内为适当的分离方法。(提示:A为乙酸乙酯,E为乙醇)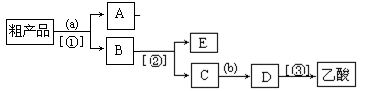
试剂a是__________,分离方法①是_________________,分离方法②是___________