碳酸钠和碳酸氢钠是生活中常见的盐,通过实验验证、探究它们的化学性质。查阅资料①Na2CO3 + CaCO3 = CaCO3↓+ 2NaCl
①2NaHCO3 Na2CO3 +CO2↑+ H2O
③Ca(HCO3)2易溶于水。
④CaCl2溶液分别与NaHCO3、Na2CO3溶液等体积混合现象(表中的百分数为溶液中溶质的质量分数)
| |
NaHCO3 |
Na2CO3 |
|||
| 0.1% |
1% |
5% |
0.1% |
||
| CaCl2 |
0.1% |
无明显现象 |
有浑浊 |
有浑浊源 |
有浑浊 |
| 1% |
无明显现象 |
有浑浊 |
有浑浊,有微小气泡 |
有沉淀 |
|
| 5% |
无明显现象 |
有浑浊 |
有浑浊,有大量气泡 |
有沉淀 |
【进行实验】
| 序号 |
实验装置 |
主要实验步骤 |
实验现象 |
| 实验1 |
 |
向 2支试管中分别加入少 量Na2CO3 和NaHCO3 溶液,再分别滴加盐酸 |
2支试管中均有气泡产生 |
| 实验2 |
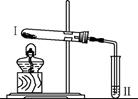 |
向Ⅱ中加入试剂a,向Ⅰ中 加入少量Na2CO3 或 NaHCO3 固体,分别加热一 段时间 |
Na2CO3 受热时Ⅱ中无明 显现象 NaHCO3受热时Ⅱ中出现 浑浊 |
| 实验3 |
 |
向Ⅱ中加入试剂a,向Ⅰ中 加入少量5%的NaHCO3溶 液,再滴加5%的CaCl2溶 液 |
Ⅰ中出现浑浊,有气泡产 生Ⅱ中出现浑浊 |
【解释与结论】
(1)实验1 中,NaHCO3与盐酸反应的化学方程式为。
(2)实验2 中,试剂a为。
(3)实验3 中,NaHCO3与CaCl2反应的化学方程式为:
2NaHCO3+ CaCl2 =" ____+_______+________+" H2O(本题1分)
【反思与评价】
(1)实验2 中,加热NaHCO3后,试管Ⅰ中残留固体成分可能为 (写出所有可能)。
(2)资料④中,NaHCO3溶液与CaCl2溶液混合的现象中,有些只观察到浑浊、未观察到气泡,原因可能是_____________。
(3)用两种不同的方法鉴别碳酸钠和碳酸氢钠固体,实验方案分别为:
① ;② ;
某实验小组为检验露置在空气中的NaOH固体是否变质并确定其组成,开展了以下探究活动。
【讨论与交流】
(1)NaOH能与空气中的__________(填化学式)发生反应生成Na2CO3。
【查阅资料】
①NaOH在空气中不会转化成NaHCO3;
②Na2CO3的水溶液呈碱性。
③CaCl2、NaCl的水溶液均呈中性。
【猜想假设】猜想一:固体全部为NaOH。
猜想二:固体全部为__________。
猜想三:固体为NaOH和Na2CO3的混合物。
【实验探究一】将待检固体溶于水配成溶液。按以下两种方案进行实验:
(2)方案一:用洁净的玻璃棒蘸取该溶液滴在pH试纸上,测得pH__________(填“>”、“<”或“=”)7,说明猜想一成立。
(3)方案二:取该溶液少许,往其中加入足量稀盐酸,有气泡产生,说明猜想_______不成立。
【归纳与总结】很明显,方案一的结论__________(填“正确”或“错误”),理由是__________。
【实验探究二】为进一步确定原固体的组成,该实验小组的同学称取42.4g待检固体于烧杯中,加入157.6g水,配成200g溶液,并将它平均分成四等份,分别加入CaCl2溶液,将产生的沉淀过滤、洗涤、干燥并称量,实验数据如下表:
| 实验项目 |
1 |
2 |
3 |
4 |
| 加入CaCl2溶液质量 |
50g |
100g |
150g |
200g |
| 产生的沉淀质量 |
4g |
8g |
10g |
10g |
(4)实验小组同学根据实验数据的分析,根据实验3所得沉淀质量计算并判断猜想__________成立,有部分同学提出不必要做实验4,理由是__________。
(5)实验小组对4次实验后的沉淀经过洗涤、干燥后再称量,如果省略洗涤沉淀的步骤,对Na2CO3的质量计算结果影响是__________(填“偏大”或“偏小”)。
【实验探究三】
(6)实验探究一的两个方案都不完善,实验探究二虽然能得出固体的组成,但它的实验操作比较复杂,请你设计一个较简单的探究方案来验证固体的组成。
| 实验操作 |
实验现象 |
实验结论 |
某化学兴趣小组在做完制取二氧化碳的实验后(用石灰石和稀盐酸制取),对反应后反应器内的剩余溶液的溶质成分产生了兴趣,他们继续进行了以下实验探究。
【分析推断】根据制取二氧化碳的反应原理,可以确定剩余溶液中一定含有氯化钙。但其中是否含有氯化氢需要通过实验来证明。若剩余溶液显酸性(含有H+),说明含有氯化氢。
【查阅资料】碳酸钙不溶于水,氢氧化钙微溶于水,氯化钙溶液呈中性。
【实验过程】将剩余的溶液倒入烧杯中,微热后冷却到室温。
| 实验操作 |
实验现象 |
实验结论 |
|
| 甲同学 |
取烧杯中溶液少许于试管中,向其中滴加①____________ |
现象:溶液变为红色 |
溶液显酸性(含有H+);溶质中有氯化氢。 |
| 乙同学 |
取烧杯中溶液少许于试管中,向其中加入少量锌粒 |
现象:②_____________ |
|
| 丙同学 |
取烧杯中溶液少许于试管中,向其中加入少量石灰石 |
现象:③_________________ 化学方程式为: ④______________________ |
【拓展提高】若要从剩余溶液中得到尽可能多的纯净的氯化钙固体,同学们认为可以向剩余溶液中加入稍过量的 ⑤__________(填化学式),经 ⑥___________、蒸发等操作后即可完成。
碳酸钠和碳酸氢钠是生活中常见的盐,通过实验验证、探究它们的化学性质。
【查阅资料】
①Na2CO3 + CaCO3 = CaCO3↓+ 2NaCl
②2NaHCO3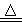 Na2CO3 +CO2↑+ H2O
Na2CO3 +CO2↑+ H2O
③Ca(HCO3)2易溶于水。
④CaCl2溶液分别与NaHCO3、Na2CO3溶液等体积混合现象(百分数为溶质质量分数)
| NaHCO3 |
Na2CO3 |
||||
| 0.1% |
1% |
5% |
0.1% |
||
| CaCl2 |
0.1% |
无明显现象 |
有浑浊 |
有浑浊 |
有浑浊 |
| 1% |
无明显现象 |
有浑浊 |
有浑浊,有微小气泡 |
有沉淀 |
|
| 5% |
无明显现象 |
有浑浊 |
有浑浊,有大量气泡 |
有沉淀 |
【进行实验】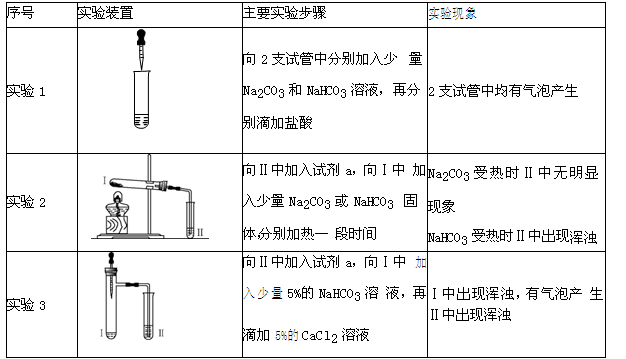
【解释与结论】
(1)实验1中,NaHCO3与盐酸反应的化学方程式为。
(2)实验2中,试剂a为。
(3)实验3中,NaHCO3与CaCl2反应的化学方程式为:
2NaHCO3+ CaCl2 ="=====" + + + H2O
【反思与评价】
(1)实验2中,加热NaHCO3后,试管Ⅰ中残留固体成分可能为(写出所有可能)。
(2)资料④中,NaHCO3溶液与CaCl2溶液混合的现象中,有些只观察到浑浊、未观察到气泡,原因可能是。
某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动。以下是教学片段,请你参与学习并帮助填写空格(包括表中空格)。
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的烧杯中。
【学生板演】该反应的化学方程式。
Ⅰ.定性探究
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【猜想】针对疑问大家纷纷提出猜想。
甲组同学的猜想如下:
猜想一:只有Na2SO4
猜想二:有Na2SO4和H2SO4
猜想三:有
猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的。你认为不合理的猜想是哪一种并说出理由。
【继续实验】
(1)丙组同学取烧杯中的少量溶液于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有。
(2)为了验证其余猜想,各组同学取烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaC12溶液、Na2CO3溶液,分别进行如下三组探究实验。
| 实验方案 |
测溶液pH |
滴加Na2CO3溶液 |
滴加BaCl2溶液 |
| 实验操作 |
 |
 |
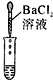 |
| 实验现象 |
试纸变色,比照比色卡,pH<7 |
产生白色沉淀 |
|
| 实验结论 |
溶液中有H2SO4 |
溶液中有H2SO4 |
溶液中有H2SO4 |
【得出结论】通过探究,全班同学一致确定猜想二是正确的。
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定。同时指出上述三个实验探究中存在两处明显错误,请大家反思。同学们经过反思发现了这两处错误:
(1)实验操作中明显的一处错误是;
(2)实验方案探究中也有一个是不合理的,不合理的原因是。
II.定量探究
取上述【演示实验】反应后烧杯中的溶液100 g,设计如下实验: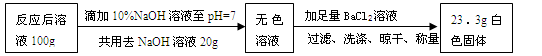
计算【演示实验】反应后溶液中Na2SO4的质量分数是多少?(请列出计算过程)
某研究性学习小组的同学用电解水的方法测定水的组成后,提出问题:“测定水的组成还有其他的方法吗?”经过讨论后,得到了肯定的答案,邀请你一起对此展开探究。
【设计方案】甲同学利用氢气还原氧化铜的原理和下图装置及药品进行实验(操作规范)。装置A中发生反应的化学方程式为①,洗气瓶B中浓硫酸的作用为 ②
【实验探究】当玻璃管中固体由黑色转变为红色时,实验测得:①装置C的玻璃管和其中固体的总质量在反应后减少了1.6g;②装置D的干燥管和其中物质的总质量在反应后增加了1.82g,用此数据算得水中H、O元素的质量比为①,而由水的化学式算得H、O元素的质量比为②。
【分析交流1】针对上述结果与理论值有偏差,乙同学认为:该装置存在缺陷,此观点得到了大家的认同,你对此改进的方法是________________。
(假设生成的水完全被D中碱石灰吸收,装置内空气中的水蒸气、CO2忽略不计)。小组同学用改进后的装置重新实验得到了正确结果。
【意外发现】丙同学不小心将反应后的少量红色固体a洒落到多量稀硫酸中了,发现除了有红色固体b以外,溶液的颜色由无色变为蓝色。
【提出问题】铜与稀硫酸是不反应的,这里溶液的颜色为什么会变蓝呢?
【查阅资料】①CuO被还原的过程中会有Cu2O生成,Cu2O也能被还原成Cu;
②Cu2O固体是红色的,它与稀硫酸的反应为:Cu2O+H2SO4=CuSO4+Cu+H2O.
【得出结论】红色固体a中含有Cu2O。
【分析交流2】红色固体a中含 有Cu2O是否会影响水组成的测定结果(填“影响”或“不影响”)。
【提出猜想】针对红色固体a的成分,小组同学提出猜想①是:Cu2O;
猜想②是:________________。
【拓展探究】丁同学利用改进后的装置及药品重新实验,通过测量反应前后固体质量的方法去确定哪种猜想成立,他已称得:①玻璃管的质量;②反应前红色固体a和玻璃管的总质量,完全反应后,你认为他还需要称量的质量。
【教师点拨】称取一定质量的红色固体a与足量的稀硫酸充分反应后,经过滤、洗涤、干燥后再称量红色固体b的质量,也可以确定哪种猜想成立。
【定量分析】小组同学再次实验,他们开始称取质量为3.6g的红色固体a,与足量的稀硫酸完全反应后得到红色固体b为2g请通过计算说明,哪个猜想成立。