某校化学研究性学习小组设计如下实验方案,测定NaHCO3和Na2CO3混合物中NaHCO3的质量分数。
方案一:按下图装置进行实验。并回答以下问题。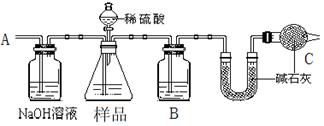
①按图组装仪器并检查装置的气密性。
②实验前称取17.90g样品,从分液漏斗滴入6mol·L-1的硫酸,直到不再产生气体时为止, 从导管A处缓缓鼓入一定量的空气。
③实验结束后测得U型管增重 8.80g。
(1)B瓶中装的试剂为______,C装置的作用是 。
(2)从导管A处缓缓鼓入一定量的空气的目的是 。
(3)该样品中NaHCO3的质量分数为 。
方案二:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量Ba(OH)2溶液。过滤洗涤,干燥沉淀,称量固体质量,进行有关计算。
请回答:实验中判断沉淀是否完全的方法是 。
某化学兴趣小组需制备22.4 LSO2气体(标准状况),他们依据化学方程式Zn+2H2SO4(浓) ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓硫酸(ρ=1.84 g/cm3)110mL充分反应,待锌粒全部溶解后,收集所得气体X。经测定其中含有气体杂质。
ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓硫酸(ρ=1.84 g/cm3)110mL充分反应,待锌粒全部溶解后,收集所得气体X。经测定其中含有气体杂质。
(1)化学兴趣小组所制得的气体X中混有的主要杂质气体可能是(填分子式)。产生这种结果的主要原因是(用离子方程式表示)。
(2)为了检验主要杂质气体的成分,化学兴趣小组的同学设计了如下实验,对气体(X)取样进行认真探究。
①组装好仪器后,盛放药品前,必要的一个操作是。
②A中加入的试剂可能是,作用是。
B中加入的试剂可能是,作用是。
③证实气体X中混有较多杂质气体,应观察到C中的实验现象是,D中最好选择的试剂是。
(3)假定气体在吸收过程吸收完全,对上述装置略加改进,可以粗略测定X气体中SO2的体积分数。改进时可选用的下列仪器为(填代号)。
a.导管 b.水槽 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
四氯化钛(TiCl4)是工业上制备金属钛的重要原料。常温下,它是一种极易水解的无色液体,沸点为136.4℃。工业制备TiCl4和钛的反应分别为:
TiO2 +2C+2Cl2 TiCl4 +2CO ;TiCl4 +2Mg
TiCl4 +2CO ;TiCl4 +2Mg  Ti + 2MgCl2
Ti + 2MgCl2
下图是实验室制备TiCl4的反应装置,主要操作步骤:
①连接好整套装置,在通Cl2前先从侧管中通入CO2气体并持续一段时间;
②当锥形瓶中TiCl4的量不再增加时,停止加热,从侧管中改通CO2气体直到电炉中的瓷管冷却为止;
③将TiO2、炭粉混合均匀后,装入管式电炉中;
④将电炉升温到800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水。
试回答下列问题:
⑴正确的操作顺序为(填序号)___________________________ 。
⑵装置A中反应的离子方程式为__________________________________ 。
⑶装置D中冷凝管进水口的位置是(填a或b)___ 。
⑷ TiCl4露置于空气中极易水解,其化学方程式可表示为_____________________ 。
⑸工业上常用金属镁在800℃高温和氩气氛围中还原TiCl4的方法制备钛,氩气的作用为__ 。
实验探究题
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题: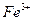 、
、 谁的氧化性更强?
谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性: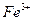 >
> ,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含__(填化学式,下同)所致。
,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含__(填化学式,下同)所致。
②乙同学认为氧化性: >
> 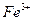 ,故上述实验现象是发生化学反应所致,则溶液呈黄色是含_▲_所致。
,故上述实验现象是发生化学反应所致,则溶液呈黄色是含_▲_所致。
(3)设计实验并验证:
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。
供选用的试剂:a. 酚酞试液 b. 四氯化碳 c. 无水酒精 d. 硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
| 选用试剂 |
实验现象 |
|
| 方案1 |
||
| 方案2 |
(4)应用与拓展:
①在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为_▲_。
②在100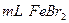 溶液中通入
溶液中通入 (标准状况),溶液中有1/3的Br-被氧化成单质
(标准状况),溶液中有1/3的Br-被氧化成单质 ,则原
,则原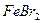 溶液中
溶液中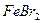 的物质的量浓度为_▲_。
的物质的量浓度为_▲_。
某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如图。该实验的主要操作步骤如下: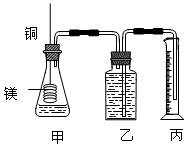
①配制浓度均为1 mol·L-1盐酸和醋酸溶液;
②用 量取10.00 mL1 mol·L-1盐酸和醋酸溶液分别加入两个锥形瓶中;
③用精确的天平分别称取除去表面氧化膜的镁带a g,并系于铜丝末端,a的数值至少为 ;
④在广口瓶中装足量的水,按图连接好装置;检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录 ;
⑥反应结束后待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应 ,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题:
⑴用文字表述④检查该装置气密性的操作与观察方法:
⑵本实验中应选用 (填序号)的量筒。 A.100 mL B.200 mL C.500 mL
⑶若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为Vm= 。
⑷简述速率不等的原因 ,铜丝不与酸接触的原因是 。
某一化学反应的实验装置如图所示: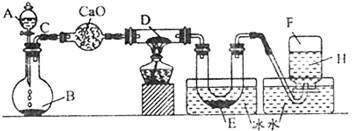
注:A—H属于下列物质中的六种物质:浓硫酸、浓盐酸、浓氨水、稀硫酸、稀盐酸、稀氯水、水、锌粒、铜片、氯化钙、氧化钙、四氧化三铁、氧化铜、氢气、二氧化碳、二氧化氮、氯气、氯化氢、氨气、氮气、氧气。
实验现象:①D物质由黑色变为红色;②无水硫酸铜粉末放入无色透明的E中得到蓝色深夜;③点燃的镁条伸入无色无味的F中,镁条继续燃烧,将生成的物质放入水中,有气体放出,并有白色浑浊物形成,该气体具有刺激性气味,并能使润湿的红色石蕊试纸变蓝。通过分析回答:
|
(1)写出下列标号的物质名称:
A ;B ;D ;E ;F 。