Ⅰ.某同学做“铝热反应”的实验。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
| 熔点/℃ |
660 |
2054 |
1535 |
1462 |
| 沸点/℃ |
2467 |
2980 |
2750 |
—— |
铝热反应方程式为 .
下列能与Al发生铝热反应的有 。(填序号)
A、MnO2 B、Na2O C、MgO D、FeO
据上表数据该同学推测,铝热反应所得到的熔融物应是铁铝合金。若证明上述所得的块状熔融物中含有金属铝,所用试剂是 ,该试剂溶质的电子式为 。
Ⅱ.某同学为了验证海带中含有碘,拟进行如下实验,请回答相关问题。
(1)第1步:灼烧。操作是将足量海带灼烧成灰烬。该过程中将使用到的实验仪器有
_______________等。(填代号,下同)
A、试管;B、坩埚;C、烧杯;D、三角架;E、泥三角;F、洒精灯;G、铁架台;H、量筒
第2步:Iˉ溶液的获取。操作是将灰烬转移到烧杯中,加适量蒸馏水,用玻棒充分搅拌,煮沸,冷却,________。(填分离方法)
(3)第3步:氧化。取(2)中溶液少量依次加入合适的试剂。下列氧化剂最好选_________。
A、浓硫酸 B、新制氯水 C、KMnO4溶液 D、H2O2
(4)第4步:碘单质的检验。操作是取少量第3步的溶液,滴加_______溶液,证明海带中含碘。
实验室制取氨与氨的有关性质实验会用到如下甲、乙、丙、丁四套装置:
(1)实验室通常利用图甲所示的装置来制取氨。简述点燃酒精灯后给试管加热的操作过程__________________________________________,说明发生装置试管口略向下倾斜的原因________________________________;
(2)图乙点滴板(或玻璃片)的3个凹穴中分别滴入1滴浓盐酸、浓硝酸和浓硫酸。然后加热NH4Cl和Ca(OH)2的混合物,当有氨放出时,移动点滴板,使导管口对准不同的酸。简述观察到的主要现象________________________________;
(3)实验室利用图丙所示的装置也可制取氨,指出所用的药品为_____________ ,利用相关化学原理解释产生氨的理由______________;
(4)某学生欲用图丁装置进行喷泉实验,结果失败,试分析失败的可能原因(至少填3个要点)_____________________________________________________;
(5)若某学生用图丁装置成功进行了喷泉实验,已知烧瓶中用排空气法收集到的氨气(标准状况下)相对H2的密度为9,则理论上得到氨水的物质的量浓度约为
____________________(精确到小数点后三位)。
为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g以下图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)
⑴仪器F的作用是。
⑵已知仪器C中装有品红溶液,其作用是 ,有人提出该溶液可能引起Na2CO3含量的测量结果比实际值偏低,理由是。
,有人提出该溶液可能引起Na2CO3含量的测量结果比实际值偏低,理由是。
⑶实验室中备有以下常用试剂:a.浓硫酸 b.品红溶液 c.酸性高锰酸钾溶液 d.氢氧化钠溶液 e.无水硫酸铜 f.碱石灰 g.五氧化二磷 h.无水氯化钙,请将下列容器中应盛放的试剂序号填入相应空格:B中,D中,E中。
实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中通入大量的空气。这样做的目的是使A、B、C、D各仪器中残留的CO2进入E被充分吸收。所通空气应先经过___________试剂(填上述所供试剂的序号)处理,否则可能引起Na2SO3含量的测量结果比实际值_________(填“偏高”,“偏低”或“没影响”)。
⑷若仪器E在试验完成时增重4.4g,则Na2CO3与Na2SO3的物质的量之比为_______,其中4.4g数值获得的方法是_______________________________。
利用Y型管与其它仪器组合可以进行许多实验(固定装置略)。分析并回答下列问题:
| ⑴ |
 |
实验目的:验证SO2有氧化性 将胶头滴管中浓硫酸分别滴入Y型管的两个支管中,在支管交叉处实验现象为________________;硫化亚铁处加水的目的是___________________。 |
| ⑵ |
 |
实验目的:探究SO2与BaCl2反应产生沉淀的条件 二氧化硫通入氯化钡溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀。则右侧Y型管中应放置的药品是_________、_________(必要时可以加热),该沉淀的化学式为____________。 |
| ⑶ |
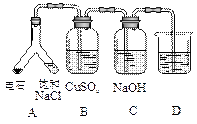 |
实验目的:探究电石气中的成分 ①装置A中的化学反应方程式为: _________________________________________。 ②B装置中出现黑色沉淀,可判断电石气中含有________;C装置的作用为__________________。 ③为验证电石气的主要成分,D中盛放________。 |
| ⑷ |
 |
实验目的:锌铁合金中铁含量的测定 ①读取量气管中数据时,若发现水准管中的液面低于量气管中液面,应采取的措施是__________ _________________________________________。 ②若称得锌铁合金的质量为0.117g,量气管中初读数为1.00mL,末读数为45.80mL,则合金中铁的质量分数为(保留2位小数,气体的体积已折算成标准状况)。 |
(16分)已知硫酸亚铁铵晶体为浅绿色,易溶于水、不溶于乙醇,在水中的溶解度比FeSO4和(NH4)2SO4都要小;能水解;具有还原性,但比硫酸亚铁稳定。
以下是将绿矾(FeSO4•7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体的流程图。根据下图回答: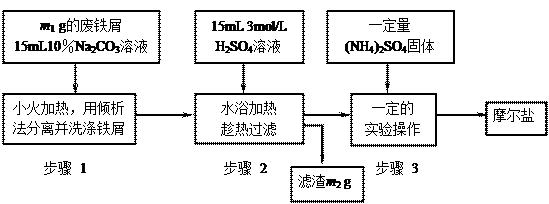
(1)为处理废铁屑表面的油污,用10%Na2CO3溶液清洗,请用离子方程式表示Na2CO3溶液呈碱性的原因: ▲。
(2)步骤1中采用倾析法分离出铁屑,下列适合用倾析法的有 ▲:
A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3)步骤2 中铁屑过量的目的是(用离子方程式表示):▲。步骤2中溶液趁热过滤的原因是 ▲。
中铁屑过量的目的是(用离子方程式表示):▲。步骤2中溶液趁热过滤的原因是 ▲。
(4)步骤3中,加入(NH4)2SO4固体后,应 加热到 ▲时,停止加热。需经过的实验操作包括: ▲、 ▲ 、减压过滤(或抽滤)等得到较为 ▲的晶体。
加热到 ▲时,停止加热。需经过的实验操作包括: ▲、 ▲ 、减压过滤(或抽滤)等得到较为 ▲的晶体。
(5)抽滤装置的仪器有: ▲、 ▲、安全瓶、抽气泵组成。
(6)产品中Fe2+的定量分析:
制得的摩尔盐样品中往往含有极少量的Fe3+。为了测定摩尔盐产品中Fe2+的含 量,一般采用在酸性下用KMnO4标准液滴定的方法。
量,一般采用在酸性下用KMnO4标准液滴定的方法。
称取4.0 g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2 mo1/L KMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液体积 10.00 mL。
①请完成滴定过程中发生的离子方程式:
Fe2++MnO4-+( )="" Mn2++Fe3++H2O
②本实验的指示剂 ▲。
A.酚酞 B.甲基橙 C.石蕊 D.不需要
③KMnO4溶液置于 ▲ (酸式、碱式)滴定管中
④终点颜色的变化: ▲。
⑤产品中Fe2+的质量分数为 ▲。 (7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为: ▲。(用a,b,c回答)
(7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为: ▲。(用a,b,c回答)
实验室用燃料法测定某种氨基酸(CxHyOzNp)的分子式组成,取Wg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现用下图所示装置置进行实验(铁架台、铁夹、酒精灯等未画出)。请回答有关问题: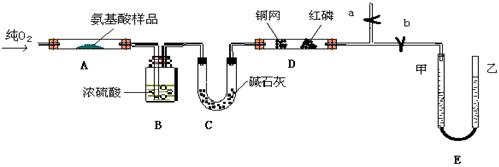
(1)实验开始时,首先打开止水夹a,关闭止水夹b,通入一段时间的氧气,这样做的
目的是,之后关闭止水夹a。
(2)由装置B、C可分别确定待测氨基酸中含有的和质量。
(3)E装置的作用是测量的体积,并由此确定待测氨基酸中含有的
的质量,为了较准确地测量该气体的体积。在读反应前后甲管中液面的读数求其差值
的过程中,应注意(填代号)。
a、视线与凹液面最低处相平 b、等待片刻,待乙管中液面不再上升时,立刻读数
c、读数时应上下移动乙管,使甲、乙两管液面相平
d、读数时不一定使甲、乙两管液面相平
(4)实验中测定的哪一数据可能不准确
其理由是
(5)严格地说,按上述方案只能确定氨基酸的。
若要确定此氨基酸的分子式,还要测定该氨基酸的。