(16分)已知硫酸亚铁铵晶体为浅绿色,易溶于水、不溶于乙醇,在水中的溶解度比FeSO4和(NH4)2SO4都要小;能水解;具有还原性,但比硫酸亚铁稳定。
以下是将绿矾(FeSO4•7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体的流程图。根据下图回答: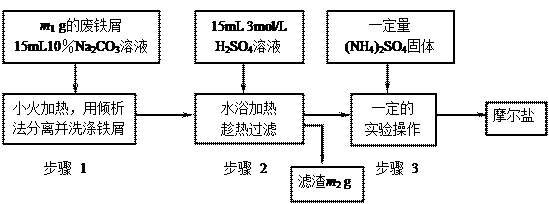
(1)为处理废铁屑表面的油污,用10%Na2CO3溶液清洗,请用离子方程式表示Na2CO3溶液呈碱性的原因: ▲ 。
(2)步骤1中采用倾析法分离出铁屑,下列适合用倾析法的有 ▲ :
A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3)步骤2 中铁屑过量的目的是(用离子方程式表示): ▲ 。步骤2中溶液趁热过滤的原因是 ▲ 。
中铁屑过量的目的是(用离子方程式表示): ▲ 。步骤2中溶液趁热过滤的原因是 ▲ 。
(4)步骤3中,加入(NH4)2SO4固体后,应 加热到 ▲ 时,停止加热。需经过的实验操作包括: ▲ 、 ▲ 、减压过滤(或抽滤)等得到较为 ▲ 的晶体。
加热到 ▲ 时,停止加热。需经过的实验操作包括: ▲ 、 ▲ 、减压过滤(或抽滤)等得到较为 ▲ 的晶体。
(5)抽滤装置的仪器有: ▲ 、 ▲ 、安全瓶、抽气泵组成。
(6)产品中Fe2+的定量分析:
制得的摩尔盐样品中往往含有极少量的Fe3+。为了测定摩尔盐产品中Fe2+的含 量,一般采用在酸性下用KMnO4标准液滴定的方法。
量,一般采用在酸性下用KMnO4标准液滴定的方法。
称取4.0 g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2 mo1/L KMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液体积 10.00 mL。
①请完成滴定过程中发生的离子方程式:
Fe2++ MnO4-+( )=" " Mn2++ Fe3++ H2O
②本实验的指示剂 ▲ 。
A.酚酞 B.甲基橙 C.石蕊 D.不需要
③KMnO4溶液置于 ▲ (酸式、碱式)滴定管中
④终点颜色的变化: ▲ 。
⑤产品中Fe2+的质量分数为 ▲ 。 (7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为: ▲ 。(用a,b,c回答)
(7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为: ▲ 。(用a,b,c回答)
根据下图转化回答有关问题:
(1)①写出AC反应生成乙酸乙酯的化学方程式_______________;
反应类型_______________;
②B的结构简式为_______________。
(2)某同学在实验室用如图所示的装置来制取乙酸乙酯。请回答下列问题:
①浓硫酸的作用是______________________________。
②饱和碳酸钠溶液的主要作用_______________。
③装置中通蒸气的导管只能插到饱和碳酸钠溶液的液面处,不能插入溶液中,目的_______________ ,长导管的作用是_______________。
④若要把制得的乙酸乙酯分离出来,应采用的实验操作是_______________。
⑤进行该实验时,最好向试管甲中加入几块碎瓷片,其目的是_______________。
⑥生成乙酸乙酯的反应是可逆反应,反应物不能完全转化为生成物,反应一段时间后,就达到了该反应的限度,即达到化学平衡状态。下列描述不能说明该反应已达到化学平衡状态的是(填序号) _______________ 。
| A.单位时间里,生成1mol乙酸乙酯,同时生成1mol水 |
| B.单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸 |
| C.单位时间里,消耗1mol乙醇,同时消耗1mol乙酸 |
| D.正反应的速率与逆反应的速率相等 |
E.混合物中各物质的浓度不再变化
为了验证镁和铝的金属性强弱,某同学欲设计实验验证。
提供的试剂有:镁带、铝条、水、盐酸、浓硫酸。
(1)所选试剂为_______________;
(2)发生反应的化学方程式为_______________;
(3)请简要叙述其操作过程及现象_______________。
将质量相等的锌片和铜片用导线相连浸入500mL硫酸铜溶液中构成如下图的装置。
(1)此装置为_______________,该装置中发生反应总的离子方程式为_______________,铜片周围溶液会出现_______________的现象。
(2)若2 min后测得锌片质量减少1.3g,则导线中流过的电子为_______________mo1。
(3)该装置的电解质溶液还可以用 _______________(答一种即可)。
下图中A~J均为中学化学中常见的物质,它们之间有如下转化关系。其中A、D为金属单质,B是一种红棕色固体。(反应过程中生成的水及其他产物已略去)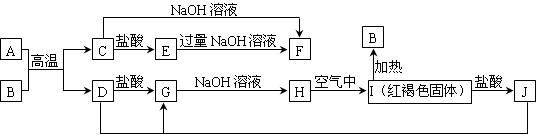
请回答以下问题:
(1)B是,H是,I是,F是。(填化学式)
(2)写出A和B的反应的化学方程式为。:
(3)写出J与D反应转化为G的离子方程式。
气体A的产量是衡量一个国家石油化工发展水平的标志,D是食醋中的主要成分。A能发生以下转化: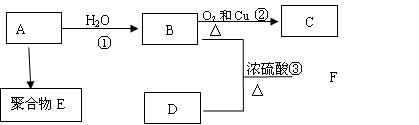
(1)A的结构简式为: 。
(2)E是(写结构简式);D中含官能团名称;
(3)写出相应转化过程的反应化学方程式
②: 反应类型: 反应
③:反应类型: 反应