元素的性质呈周期性变化的根本原因是
| A.元素的相对原子质量呈周期性变化 |
| B.元素的原子半径呈周期性变化 |
| C.元素的金属性和非金属性呈周期性变化 |
| D.元素原子的核外电子排布呈周期性变化 |
在一密闭容器中进行以下可逆反应: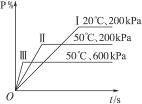
M(g)+N(g) P(g)+2L
P(g)+2L
在不同的条件下P的百分含量P%的变化情况如图,则该反应( )
| A.正反应放热,L是固体 | B.正反应放热,L是气体 |
| C.正反应吸热,L是气体 | D.正反应放热,L是固体或气体 |
可逆反应:3A(g) 3B(?)+C(?);ΔH>0,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是( )
3B(?)+C(?);ΔH>0,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是( )
| A.B和C可能都是固体 | B.B和C一定都是气体 |
| C.若C为固体,则B一定是气体 | D.B和C可能都是气体 |
已知反应A2(g)+2B2(g) 2AB2(g)(正反应放热),下列说法正确的是()
2AB2(g)(正反应放热),下列说法正确的是()
| A.升高温度,正反应速率增加,逆反应速率减小 |
| B.升高温度有利于反应速率增加,从而缩短达到平衡的时间 |
| C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 |
| D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |
乙酸蒸气能形成二聚分子:2CH3COOH(g) (CH3COOH)2(g),正反应放热;现欲测定乙酸的相对分子质量,应采用的条件是( )
(CH3COOH)2(g),正反应放热;现欲测定乙酸的相对分子质量,应采用的条件是( )
| A.高温低压 | B.低温高压 |
| C.低温低压 | D.高温高压 |
在一定条件下,可逆反应:2SO2(g)+O2(g) 2SO3(g)(正反应为放热反应)达到平衡,当单独改变下列条件后,有关叙述正确的是( )
2SO3(g)(正反应为放热反应)达到平衡,当单独改变下列条件后,有关叙述正确的是( )
| A.加催化剂,v(正)和v(逆)都发生变化,且变化的倍数相等 |
| B.加压,v(正)、v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数 |
| C.降温,v(正)减小,v(逆)增大,平衡向正方向移动 |
| D.充入氩气,v(正)、v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数 |