下列变化过程,属于放热过程的是
| A.酸碱中和反应 | B.液态水变成水蒸气 |
| C.弱酸弱碱电离 | D.用FeCl3饱和溶液制Fe(OH)3胶体 |
一定量的某有机物溶解于适量的NaOH溶液中,滴入酚酞,溶液呈红色,煮沸5 min后,溶液颜色变浅,再加入盐酸显酸性,沉淀出白色晶体。取少量晶体放到FeCl3溶液中,溶液呈紫色,则该有机物可能是( )
| A.OHCOOCH3 | B.CH2OHCOOCH3 |
| C.OHCOOH | D.COOHCOOCH3 |
下列各组物质,可用一种试剂加以区别的是( )
①四种无机溶液:NaAlO2、AlCl3、K2CO3、Na2SiO3
②四种白色粉末:(NH4)2SO4、NH4Cl、Na2SO4、NaCl
③四种有机溶液:乙醛、乙酸、甲酸、乙醇
④四种有机物:苯、四氯化碳、己烯、无水醋酸
A.只有①② B.只有③④
C只有①②④ D.全部
在一定条件下,下列药物的主要成分都能发生①取代,②加成,③水解,④中和四种反应的是( )
| A.维生素B5NCOOH |
| B.阿司匹林COOHOCOCH3 |
| C.芬必得(CH3)2CHCH2CH(CH3)COOH |
| D.摇头丸CH2COHCH3NHCH3 |
下列文字表述与反应方程式对应且正确的是( )
| A.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+===AgBr↓ |
| B.用醋酸除去水垢:CaCO3+2H+===Ca2++H2O+CO2↑ |
| C.利用腐蚀法制作印刷线路板:Fe3++Cu===Fe2++Cu2+ |
D.实验室用液溴和苯在催化剂作用下制溴苯:+Br2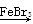 Br+HBr Br+HBr |
有甲酸、乙酸、乙醛、乙酸乙酯、乙醇、溴乙烷6种无色溶液,只用一种试剂就可以将它们一一鉴别出来。这种试剂是( )
| A.蒸馏水 | B.FeCl3溶液 |
| C.Cu(OH)2悬浊液 | D.NaOH溶液 |