(8分)元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)Cl2的电子式是 。新制的氯水可用于漂白,工业上将氯气制成漂白粉的目的是 ,漂白粉是一种 (填“混合物”或“纯净物”)。
(2)碘元素在元素周期表中的位置是 ;为防缺碘,食盐中常添加碘酸钾,该物质内存在 键(填化学键类型)。
(3)溴单质是唯一常温下呈液态的非金属单质,液溴的保存通常采取的方法是 。
(4)已知:X2(g)+H2(g) 2HX(g) (X2表示Cl2、Br2和I2)。下图表示平衡常数K与温度T的关系。
2HX(g) (X2表示Cl2、Br2和I2)。下图表示平衡常数K与温度T的关系。
① H表示X2与H2反应的晗变,H 0。(填“>”、“<”或“=”)
H表示X2与H2反应的晗变,H 0。(填“>”、“<”或“=”)
②曲线a表示的是 (填“Cl2”、“Br2”或“I2”)与H2反应时K与T的关系。
(每空2分,共10分)铁元素是重要的金属元素,单质铁在工业和生活中使用得最为广泛。铁还有很多重要的化合物及其化学反应。
如铁与水反应:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g)△H
(1)上述反应的平衡常数表达式K=_____________。
(2)已知:①3Fe(s)+2O2(g)=Fe3O4(s)△H1=-1118.4kJ·mol-1
②2H2(g)+O2(g)=2H2O(g)△H2=-483.8 kJ·mol-1
③2H2(g)+O2(g)=2H2O(l)△H3=-571.8 kJ·mol-1
则△H=_____________。
(3)在t℃时,该反应的平衡常数K=16,在2L恒温恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| Fe |
H2O(g) |
Fe3O4 |
H2 |
|
| 甲/mol |
1.0 |
1.0 |
1.0 |
1.0 |
| 乙/mol |
1.0 |
1.5 |
1.0 |
1.0 |
①甲容器中H2O的平衡转化率为_____________(结果保留一位小数)。
②下列说法正确的是_____________(填编号)
A.若容器压强恒定,则反应达到平衡状态
B.若容器内气体密度恒定,则反应达到平衡状态
C.甲容器中H2O的平衡转化率大于乙容器中H2O的平衡转化率
D.增加Fe3O4就能提高H2O的转化率
(4)若将(3)中装置改为恒容绝热(不与外界交换能量)装置,按下表充入起始物质,起始时与平衡后的各物质的量见表:
| Fe |
H2O(g) |
Fe3O4 |
H2 |
|
| 起始/mol |
3.0 |
4.0 |
0 |
0 |
| 平衡/mol |
m |
n |
p |
q |
若在达平衡后的装置中继续加入A、B、C三种状况下的各物质,见表:
| Fe |
H2O(g) |
Fe3O4 |
H2 |
|
| A/mol |
3.0 |
4.0 |
0 |
0 |
| B/mol |
0 |
0 |
1 |
4 |
| C/mol |
m |
n |
p |
q |
当上述可逆反应再一次达到平衡状态后,上述各装置中H2的百分含量按由大到小的顺序排列的关系是___________(用A、B、C表示)。
(每空2分,共6分)请根据醋酸的电离平衡回答下列问题:
(1)常温下,0.1mol/L 的CH3COOH溶液中有l%的CH3COOH分子发生电离,则溶液的pH= 。
(2)将上述溶液加蒸馏水稀释,在稀释过程中,下列各项中增大的是 (填字母编号)。
| A.c(H+) | B.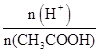 |
C.c(H+)·c(OH-) | D.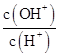 |
(3)25℃时,CH3COOH的电离平衡常数为1.75×10-5,现将一定量的CH3COOH与NaOH溶液混合,若测得混合液pH=5.6,则混合液中各离子浓度由大到小的顺序是 。
(每空2分,共8分)研究硫及其化合物性质有重要意义。
(1)Cu2S在高温条件下发生如下反应:2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g)⊿H=-773kJ/mol,当该反应有0.2mol SO2生成时,反应释放出的热量为___________kJ。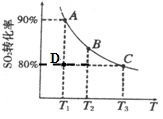
(2)硫酸工业生产中涉及如下反应:2SO2(g)+O2(g) 2SO3(g)。向2L的容器中充入2molSO2、1molO2,SO2的平衡转化率与温度的关系如图所示。T1温度时反应进行到状态D时,v(正) v(逆)(填“>”、“<”或“=”)。温度为T1时,反应的平衡常数K= 。若在T3温度时,达平衡时测得反应放出的热量为Q1。此时再向容器中加入2molSO2、1molO2并使之重新达到平衡,测得又放出热量Q2。则下列说法正确的是 。(填字母编号)
2SO3(g)。向2L的容器中充入2molSO2、1molO2,SO2的平衡转化率与温度的关系如图所示。T1温度时反应进行到状态D时,v(正) v(逆)(填“>”、“<”或“=”)。温度为T1时,反应的平衡常数K= 。若在T3温度时,达平衡时测得反应放出的热量为Q1。此时再向容器中加入2molSO2、1molO2并使之重新达到平衡,测得又放出热量Q2。则下列说法正确的是 。(填字母编号)
a.容器的压强增大原来的两倍
b.Q2一定等于Q1
c.新平衡时SO2的转化率一定大于80%
d.T3时的平衡常数大于T1时的平衡常数
I. (1)在Al2(SO4)3和MgSO4组成的混合物中,Al3+与Mg2+的物质的量之比为2∶3,则在含有4 mol SO42-的混合物中,MgSO4的质量是______________克。
(2)V ml Al2(SO4)3溶液中含有Al3+ a g,取V/4 ml溶液稀释到4V ml,则稀释后溶液中SO42-的物质的量浓度是______________ mol/L。
II.在120 ℃时分别进行如下四个反应:
| A.2H2S (g) + O2 (g) ==2H2O (g)+2S (s) | B.2H2S (g)+3O2 (g)==2H2O (g)+2SO2 (g) |
| C.C2H4(g)+3O2 (g)==2H2O (g)+2CO2 (g) | D.C4H8 (g)+6O2 (g)==4H2O (g)+4CO2 (g) |
(1)若反应在容积固定的容器内进行,反应前后气体密度(d)和气体总压强(p)分别符合关系式d前=d后和p前>p后的是__________;符合关系式d前=d后和p前=p后的是__________。(请填写反应的代号)
(2)若反应在压强恒定容积可变的容器内进行,反应前后气体密度(d)和气体体积(V)分别符合关系式d前>d后和V前<V后的是________;符合d前>d后和V前>V后的是________。(请填写反应的代号)
酸、碱、盐溶液能够导电,是因为物质溶于水时,离解成为自由移动的阴、阳离子。在酸的溶液里,酸根离子所带负电荷的总数等于酸电离时生成的H+的总数:
(1)下列物质的电离方程式如下:HClO4═H++ClO4-; Ba(OH)2═Ba2++2OH-;
Fe2(SO4)3═2Fe3++3SO42-; KHSO4═K++H++SO42-.
属于酸的物质____________________(写化学式);
(2)化工生产常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
①从物质的分类角度看,不恰当的一种物质是____________________。
②上述物质中既不是电解质也不是非电解质的是________________________。
(3)写出下列物质在水溶液里的电离方程式:
①NaHCO3 ___________________②H2SO4________________________
(4)有人说可将无机化合物KHSO4与NaHCO3归为同一类别,你认为他的理由主要是___________________;有人说可将无机化合物KHSO4与H2SO4归为同一类别,你认为他的理由主要是__________________;
(5)若将NaHSO4与Ba(OH)2在溶液中按物质的量之比为2:1混合,该反应的离子方程式为:_______________________;
若将NaHSO4与Ba(OH)2在溶液中按物质的量之比为1:1混合,该反应的离子方程式为:_______________________;