某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。
已知:p(Ba2+)=-lgc(Ba2+),p(SO42-)=-lgc(SO42-)。下列说法正确的是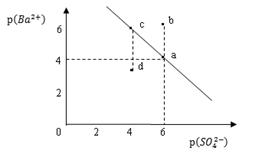
| A.该温度下,Ksp (BaSO4 )=1.0×10-24 |
| B.a点的Ksp (BaSO4 )小于b点的Ksp (BaSO4 ) |
| C.d点表示的是该温度下BaSO4的不饱和溶液 |
| D.加入BaCl2可以使溶液由 c点变到a点 |
已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是
A.气态氢化物的稳定性:D>C
B.原子序数:b>a>c>d
C.最高价氧化物对应水化物的碱性:B>A
D.四种元素一定属于短周期元素
下列离子方程式不正确的是
| A.苯酚钠溶液与二氧化碳反应: 2C6H5O-+ CO2 + H2O = 2C6H5OH + CO32- |
| B.在亚硫酸钡沉淀中加入稀硝酸后,沉淀不溶解: 3BaSO3+2H++2NO3-=3BaSO4↓+2NO↑+H2O |
| C.碳酸钠溶液中通入少量SO2: 2CO32-+SO2+H2O=2HCO3-+SO32- |
| D.氧化铁溶于氢碘酸:Fe2O3+6H+=2Fe3++3H2O |
下列各组离子在指定溶液中,能大量共存的是
①无色溶液中:K+,Cl-,Ca2+,SO42-,NO3-
②pH=11的溶液中: Na+,AlO2-,NO3-,S2-,SO32-
③水电离的H+浓度c(H+)=10-12mol·L-1的溶液中:Cl-,NO3-,NH4+,SO32-
④加入Mg能放出H2的溶液中:Mg2+,NH4+,Cl-,K+,SO42-
⑤使石蕊变红的溶液中:Fe2+,MnO4-,NO3-,Na+,SO42-
⑥中性溶液中:Fe3+,Al3+,NO3-,Cl-,S2-
| A.①②⑤ | B.①③⑥ | C.②④ | D.①②④ |
下列颜色不属于因化学反应而产生的现象的是
| A.无色试剂瓶中的浓硝酸呈黄色 |
| B.久置的KI溶液呈黄色 |
| C.新制氯水久置后变为无色 |
| D.普通玻璃导管口点燃纯净氢气时,火焰呈黄色 |
用下列装置进行的实验,不能达到相应实验目的的是
| A.装置甲:吸收尾气HCl | B.装置乙:制取金属锰 |
| C.装置丙:洗气除去CO2中的SO2 | D.装置丁:实验室制取NH3 |