按下列要求写出由第二周期非金属元素组成的中性分子的相关内容:
(1)平面三角形分子:分子式 ,中心原子杂化方式是 .
(2)三角锥形分子:分子式 ,VSEPR模型的名称为 .
(3)正四面体形分子:结构式
(4)与O22+互为等电子体的一种化合物的分子式为 ,O22+的电子式可表示为_____,1mol O22+ 中含有的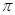 键数目为_____。
键数目为_____。
(9分).邻羟基苯甲酸(俗名水杨酸)其结构简式为 :
:
(1).水杨酸既可以看成是__________类物质,同时也可以看成是_____________类物质。
(2).将其与_______________溶液作用生成物的化学式为C7H5O3Na
将其与_______________溶液作用生成物的化学式为C7H4O3Na2
(3).水杨酸的不同类同分异构体中,属于酚类且也具有苯环的化合物的结构简式为______________,它还可看成是__________类物质。
(4).比水杨酸多一个CH2原子团,且与水杨酸属于同系物的取代基数目不同的两类物质的结构简式分别为___________________ ________________
(5).比水杨酸多一个CH2原子团,且与水杨酸不属于同系物的两类物质的结构简式分别为_________________________________________
(15分)向一个体积可变的密闭器中充入4molA、1molB,发生如下反应:
4A(g)+B(s)  3C(s)+4D(g)。在高温下达到平衡,测得混合气体中D的浓度为0.3mol·L-1。
3C(s)+4D(g)。在高温下达到平衡,测得混合气体中D的浓度为0.3mol·L-1。
请填写下列空白:
(1)若容器体积为10L,反应经2min达平衡,则以A物质浓度变化表示的化学反应率为
。
(2)若压缩容器增大压强,则逆反应的速率,容器中D的体积分数。(填“增大”“减小”“不变”)
(3)若相对分子质量M(B)>3M(C),温度升高时混合气体的平均相对分子质量减少,则正反应。(填“吸热”或“放热”)
(4)在最初的容器改充1.5molC、4.4molD温度保持不变,要使反应达平衡时D的浓度为0.6mol·L-1,则容器的体积是L。
(16分)已知 —C(OH)2—不稳定. 由丙烯经下列反应可得到F、G两种高分子化合物,它们都是常用的塑料。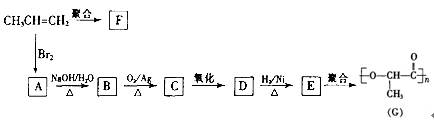
(1)聚合物F的结构简式是。
(2)D的结构简式是。
(3)B转化为C的化学方程式是
(4)在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简式。
(5)写出 C 与新制备的银铵溶液反应的化学方程式
(6)写出同时符合下列条件:①含有—OH的酯②水解产物稳定(一个碳原子上接两个羟基,存在―O―O-键的物质不稳定)
属于D的同分异构体的结构简式:
A、B、C、D均为短周期元素。A、B可形成两种液态化合物,其最简式分别为BA和B2A。A与D可形成气态化合物DA、DA2。A、B、D可组成离子化合物,该晶体化学式为B4A3D2,其水溶液呈弱酸性。B与D可形成一种极易溶于水的碱性气体X。B与C可形成极易溶于水的酸性气体Y。已知X分子与B2A分子中的电子数相等。Y分子与最简式为BA的分子中的电子数相等。请回答:
(1)写出元素的名称:A,C。
(2)Y分子是(填极性和非极性)分子。
(3)写出C2+ X(过量)→ D反应的化学方程式。
(4)B4A3D2水溶液呈酸性,写出其呈酸性的离子方程式
(5)已知液态X与B2A相似,也可以发生微弱的电离,电离出含相同电子数的离子,则X的电离方程式为:
(6)D元素最高价氧化物对应的水化物的溶液与D元素最高价氧化物的水化物和它的氢化物所形成的化合物的溶液的PH均为5(室温下),则两溶液中水电离出的氢离子的个数之比:。
(1)写出铝热法炼铁的化学方程式
(2)氢氧燃烧电池是一种高效低污染的新型电池,主要用于航天领域。它的电极材料一般为活化电极,具有很强的催化活性,如铂电极、活性炭电极等。电解质溶液一般为40%的KOH溶液。请写出电极反应式:
负极: ______________________________
正极: ______________________________
(3)在中国古代的《淮南万毕术》里,就有湿法炼铜:"曾青得铁则化为铜"的记载。曾青又名空青、白青、石胆、胆矾等,其实都是天然的硫酸铜。请根据“湿法炼铜”的反应设计一个原电池装置,在右边方框中画出原电池的装置图,标出正、负极和电解质溶液。