卤族元素的单质与H2反应过程中的能量变化如图所示,其中a、b、c、d分别表示卤族中某一元素的单质, E为相同物质的量的单质与H2反应过程中的能量变化(
E为相同物质的量的单质与H2反应过程中的能量变化( E越大,表明反应越容易发生)。
E越大,表明反应越容易发生)。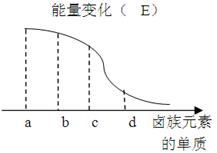
请回答下列问题:
d为_____(写化学式) ,红热的铜丝在b单质中燃烧的现象为 .
b与H2反应的条件为______________ .
(2)由该能量变化示意图可得出的结论是同一主族,自上而下,元素的非金属性依次 .
用浓盐酸来制取氯气的化学方程式如下:2KMnO4 +16HCl ="2KCl" +2MnCl2 + 5Cl2↑+8H2O,其中被还原的元素是,被氧化的元素是,氧化剂是 ,还原剂是,氧化产物是,还原产物是,假如有2.5 molCl2生成,则该反应中电子转移数目为___________________。
,还原剂是,氧化产物是,还原产物是,假如有2.5 molCl2生成,则该反应中电子转移数目为___________________。
现有以下物质:①NaCl晶体②液态SO3③液氯④铜⑤BaSO4固体⑥纯蔗糖(C12H22O11)⑦酒精(C2H5OH)⑧熔化的KNO3⑨盐酸⑩NH3
请回答下列问题(用序号填空):
⑴以上物质中能导电的是_________________。
⑵以上物质中属于电解质的是___________________。
⑶以上物质中属于非电解质的是____________________。
⑷以上物质中溶于水后形成的水溶液能导电的是_____________。
(1)常温下,将1 mL pH=1的H2SO4溶液加水稀释到100 mL,稀释后的溶液中=。
(2)某温度时,测得0. 01 mol·L-1的NaOH溶液的pH为11,则在该温度下水的离子积常数KW=_,该温度25℃。
01 mol·L-1的NaOH溶液的pH为11,则在该温度下水的离子积常数KW=_,该温度25℃。
(3)常温下,pH=13的Ba(OH)2溶液aL与 pH=3的H2SO4溶液bL混合(混合后溶液体积变化忽略不计)。
pH=3的H2SO4溶液bL混合(混合后溶液体积变化忽略不计)。
若所得混合溶液呈中性,则a∶b=
若所得混合溶液pH=12,则a∶b=
(4)在(2)所述温度下,将pH=a的NaOH溶液VaL与pH=b的硫酸VbL混合。
若所得混合液为中性,且a=12,b=2,则Va∶Vb=
若所得混合液的pH=10,且a=12,b=2,则Va∶Vb=
(1)体积相同,浓度均为0.2 mol/L的盐酸和CH3COOH溶液,分别加水稀释10倍,溶液的pH分别变成m和n,则m与n的关系为。
(2)体积相同,浓度均为0.2mo l/L的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为。
l/L的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为。
(3)体积相同,pH均等于13的氨水和NaOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成9,则m与n的关系为。
有两个起始体积相同的密闭容器A和B,A容器有一个可移动的活塞,能使容器内保持恒压;B容器为固定体积。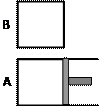
起始时这两个容器分别充入等量的体积比为2∶1的SO2和O2的混合气,并使A、B容器中气体体积相等,并保持在400℃条件下发生反应2SO2+O2 2SO3,并达到平衡。
2SO3,并达到平衡。
⑴ 达到平衡所需时间,A容器比B容器,两容器中SO2的转化率A比B。
⑵ 达到⑴所述平衡后,若向两容器中分别通入等量Ar气体,A容器的化学平衡移动,B容器中的化学平衡移动。
⑶ 达到⑴所述平衡后,若向容器中通入等量的原混合气体,重新达到平衡后,A容器中SO3的体积分数,B容器中SO3的体积分数(填变大、变小、不变)。