(1)纯净物根据其组成和性质可进行如下分类: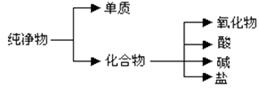
上图所示的分类方法属于 (填序号)
A.交叉分类法 B.树状分类法
下列2组物质中均有一种物质的类别与其它2种不同
A.CaO、Na2O、SiO2 B.Al(OH)3、KOH、Ba(OH)2
以上两组物质中,每组里与别的两物质的类别明显不同的物质依次是(填化学式) ; 。
写出能用离子方程式CO32- + 2H+="=" CO2↑+H2O表示的一个化学反应方程式: 。
(2)下图为实验室制取氨的实验装置。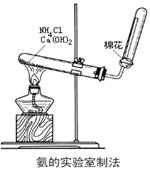
①写出A中所发生反应的化学方程式 。
②该装置还可以制备哪些气体________。
③在收集氨时试管口棉花团的作用是 。
④收集氨气应使用___法,要得到干燥的氨气可选用___作干燥剂,检验集满的方法是 。
1000mL某待测液中除含有0.2 mol·L-1的Na+外,还可能含有下列离子中的一种或多种:
| 阳离子 |
K+、NH4+、Fe3+、Ba2+ |
| 阴离子 |
Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |
现进行如下实验操作(所加试剂均过量):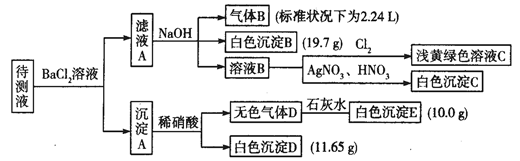
(1)写出生成白色沉淀B的离子方程式:___________________________________。
(2)待测液中肯定不存在的阳离子是_________________。
(3)若无色气体D是单一气体:
①将阴离子的物质的量浓度填入下表中(一定不存在的填“0”,不能确定的填“?”):
| 阴离子 |
Cl- |
Br- |
CO32- |
HCO3- |
SO32- |
SO42- |
| 浓度/ mol·L-1 |
②判断原溶液中K+是否存在,若存在,求其物质的量浓度的最小值,若不存在,请说明理由:
________________________________________________________________。
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是____________________________。
②沉淀A中能还原稀硝酸的成分是______________________________(写化学式)。
氯碱工业的原料饱和食盐水中含有一定量的铵根离子,在电解时会生成性质极不稳定的三氯化氮,容易引起爆炸。
(1)三氯化氮易水解,其水解的最初产物除生成氨气外,另一产物为。
(2)为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气。该反应的离子方程式为;该工艺选择氯气的优点是。(答一点即可)
(3)过量氯气用Na2S2O3除去,反应中S2O32-被氧化为SO42-。若过量的氯气为1×10-3 mol,则理论上生成的SO42-为mol。
(4)生产和实验中广泛采用甲醛法测定样品的含氮量。甲醛和铵根离子的反应如下:
4NH4+ + 6HCHO =(CH2)6N4H+(一元酸)+ 3H+ + 6H2O
实验步骤如下:
①已知甲醛溶液中常含有甲酸。取b mL甲醛溶液(过量)于锥形瓶,加入1滴酚酞,用浓度为c mol/L的NaOH溶液中和,滴定管的初始读数V1 mL,当溶液呈微红色时,滴定管的读数V2 mL。
②向其中加入饱和食盐水试样a mL,静置数分钟。
③再加1~2滴酚酞,再用上述NaOH溶液滴定至微红色,滴定管的读数V3 mL。
则饱和食盐水中的含氮量为mg/L。
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下: 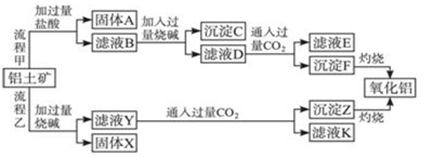
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为______________________________。
(2)流程乙加入烧碱后生成SiO32-的离子方程式为_____________________________。
(3)验证滤液B含Fe3+,可取少量滤液并加入_______________(填试剂名称)。
(4)滤液D产生沉淀F的离子方程式为______________________________。
(5)滤液E、K中溶质的主要成分是____(填化学式),写出该溶质的一种用途_______。
硫酸钠-过氧化氢加合物(xNa2SO4·yH2O2·zH2O)的组成可通过下列实验测定:①准确称取1.7700 g样品,配制成100.00 mL溶液A。②准确量25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.5825 g。③准确量取25.00 mL溶液A,加适量稀硫酸酸化后,用0.020 0mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液25.00 mL。H2O2与KMnO4反应的离子方程式如下:2MnO4-+5H2O2+6H+===2Mn2++8H2O+5O2↑。
(1)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42-)≤1.0×10-6mol·L-1,应保持溶液中c(Ba2+)≥_______mol·L-1。
(2)上述滴定若不加稀硫酸酸化,MnO4-被还原为MnO2,其离子方程式为。
(3)通过上述实验事实,该样品的组成为(写化学式)。
(4)上述实验③KMnO4溶液滴定至终点的现象是)_____________,怎样判断滴定达到了终点。
通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答:
(1)用化学符号表示下列4种微粒:A:B :C:D :;
(2)写出A、B、E三种微粒反应的离子方程式:、 。