工业制备氯化铜时,将浓盐酸用蒸气加热到80℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO),充分搅拌使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液[参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3]。请回答以下问题:
(1)第一步除Fe2+,能否直接调整pH=9.6将Fe2+沉淀除去?______,理由是_____________________。
有人用强氧化剂NaClO将Fe2+氧化为Fe3+:
①加入NaClO后,溶液的pH变化是___________(填序号);
A.一定增大 B.一定减小
C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当?__________,理由是____________________________。
③现有下列几种常用的氧化剂,可用于除去该混合溶液中Fe2+的有_________(填序号)。
A.浓HNO3 B.KMnO4 C.Cl2 D.O2
(2)除去溶液中的Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH调整到3.7,可选用的有__________(填序号)。
A.NaOH B.氨水 C.Cu2(OH)2CO3 D.Na2CO3
如图是现今常规生产发烟硫酸和硫酸的流程图:
(1)在④处二氧化硫被氧化成三氧化硫,④的设备名称是.该处发生反应的方程式为.为提高三氧化硫的产率,该处应采用(填“等温过程”或“绝热过程”)为宜.
(2)在⑦处进行二次催化处理的原因是.
(3)⑤处气体混合物主要是氮气和三氧化硫.此时气体经过⑥后不立即进入⑦是因为:.
(4)20%的发烟硫酸(SO3的质量分数为20%)1吨需加水吨(保留2位有效数字)才能配制成98%的成品硫酸.
(5)在②处发生1500℃的“不完全燃烧”,即先混入少量干燥空气,然后在③处于700℃下再继续燃烧.试简述这种燃烧方式对环境保护是有利的原因.
工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。
(1)某温度下,2SO2(g)+O2(g) 2SO3(g)△H="-197" kj/mol。开始时在10 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出197kJ的热量,该温度下的平衡常数K=,升高温度K将(填“增大、减小或不变”)。
2SO3(g)△H="-197" kj/mol。开始时在10 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出197kJ的热量,该温度下的平衡常数K=,升高温度K将(填“增大、减小或不变”)。
(2)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2,发生下列反应: 2SO2(g)+O2(g) 2SO3(g),达到平衡后,改变下述条件,SO2、O2、SO3的平衡浓度都比原来增大的是(填字母)。
2SO2(g)+O2(g) 2SO3(g),达到平衡后,改变下述条件,SO2、O2、SO3的平衡浓度都比原来增大的是(填字母)。
A.恒温恒容,充入2mol SO3 B.恒温恒容,充入2mol N2
C.恒温恒压,充入1 mol SO3 D.升高温度
(3)在一密闭容器中进行下列反应:2SO2(g)+O2(g)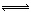 2SO3(g),化学兴趣小组的同学探究了其他条件不变时,改变某一条件时对上述反应的影响,并根据实验数据作出了下列关系图。下列判断中正确的是(填字母)。
2SO3(g),化学兴趣小组的同学探究了其他条件不变时,改变某一条件时对上述反应的影响,并根据实验数据作出了下列关系图。下列判断中正确的是(填字母)。
A.图Ⅰ研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且乙的温度较低
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
(4)某实验小组设想如下图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
SO2(g)+O2(g) 2SO3(g)△H1="-197" kJ/mol;
2SO3(g)△H1="-197" kJ/mol;
H2O(g)=H2O(1)△H2="-44" kJ/mol:
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(1) H3="-545" kJ/mol。
写出SO3(g)与H2O(1)反应的热化学方程式是。
(6)由硫酸可制得硫酸盐.在一定温度下,向K2SO4溶液中滴加Na2CO3溶液和BaCl2溶液,当两种沉淀共存时,SO42-和CO32-的浓度之比。[已知该温度时,Ksp(BaSO4)=1.3x10-10,KsP(BaCO3)=5.2x10-9]。
某工厂用软锰矿(含MnO2约70%及Al2O3)和闪锌矿(含ZnS约80%及FeS),共同生产MnO2和Zn(干电池原料)。
已知:①A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液。
②IV中的电解反应式为MnSO4+ZnSO4+2H2O  MnO2+Zn+2H2SO4。
MnO2+Zn+2H2SO4。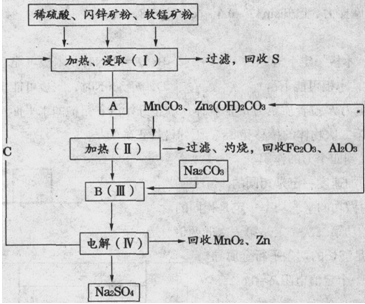
(1)A中属于还原产物的是。
(2)MnCO3、Zn2(OH)2CO3的作用是;Ⅱ需要加热的原因是;C的化学式是。
(3)Ⅲ中发生的离子方程式为,;
(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是。
短周期元素X、Y、Z、W原子序数依次增大。X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中。请回答:
(1)X氢化物的电子式是_________________________________________。
(2)X氢化物的水溶液与W氢化物的水溶液混合后恰好反应时,溶液呈(填“酸”、“碱”或“中”)性,用离子方程式表示其原因是_____________________________________.
(3)Y—AgO电池是应用广泛的鱼雷电池,其原理如图所示。
该电池的负极反应式是___________________________________。
(4)Z和W比较,非金属性较弱的是_______________(填元素符号),下列不能验证这一结论的是________(填序号)。
a.元素在地壳中的含量
b.最高价氧化物对应水化物的酸性
c.断开氢化物中1 mol H—Z或H—W键所需的能量
d.Z与W以共价键形成化合物时,Z或W显示的电性
亚氯酸钠(NaClO2)主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等,亚氯酸钠受热易分解。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下:
(1)提高“反应l”反应速率的措施有________________________(写出一条即可)。
(2)“反应2”的氧化剂是_____________,该反应的化学方程式为__________________。
(3)采取“减压蒸发”而不用“常压蒸发”,原因是__________________。
(4)从“母液”中可回收的主要物质是__________________________。
(5)“冷却结晶”后经______________(填操作名称)即可获得粗产品。