自来水生产过程如下:
取水后,加入药品反应生成具有吸附性能的氢氧化铝,氢氧化铝的化学式是 (1) ,属于 (2) (填“酸”、“碱”、“盐”)。通过沉淀、过滤除去 (3) 杂质,属于 (4) 变化。在消毒过程中通入氯气,0.1mol氯气中约含有 (5) 个氯气分子,它与水反应生成盐酸和次氯酸(HClO),次氯酸中氯元素的化合价为 (6) 。
海水是巨大的资源宝库。如下图所示利用海水为原料可获得许多化工产品:
(1)要鉴别海水是硬水还是软水,可选用的试剂是;
(2)步骤①中选用蒸发结晶法而不用降温结晶法的理由是;
(3)制纯碱过程中,其中过滤操作所需要的玻璃仪器有烧杯、漏斗和;
(4)步骤②发生反应的化学方程式是,其基本反应类型为(选填“化合”、“分解”、“置换”或“复分解”)反应;
(5)步骤④发生的反应为置换反应(类似于金属与盐溶液之间的反应),试写出该反应的化学方程式。
化学来源于生活,服务于生活。请回答下列生活中的有关问题:
(1)厨房中有下列几种食物:①黄瓜、②牛奶、③大米。其中富含蛋白质的是(填序号,下同),富含维生素的是;
(2)家庭餐桌上的餐具有:①竹筷子、②塑料水杯、③不锈钢勺子,其中属于合成有机高分子材料(简称合成材料)制造的是;
(3)泡茶时,为将茶叶与茶水分离,可在茶杯内装上纱网,该设计利用的化学实验操作原理是;
(4)热水瓶用久后,瓶胆内壁常附着有一层水垢【主要成分是CaCO3和Mg(OH)2】。下列物质能除去瓶内水垢的是(填序号) ①白酒 ②食醋 ③苏打水
(5)锂广泛用于电池、贮氢等领域,锂在化合物中显+1价。下图周期表中的信息及4种粒子的结构示意图。
①从图A中数值获得的一条信息是;
②B、C、D、E 中,和(填编号)属于同种元素;
③LiMnO2是一种电极材料,其中 Mn 的化合价为;
④用化学符号表示:锂离子。
下面三个实验采用的是对比实验方法进行的有关探究。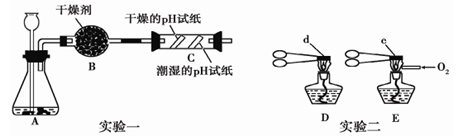
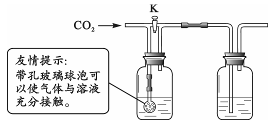
实验三 F G
(1)用实验一所示装置进行二氧化性质的探究。
当长颈漏斗中的稀盐酸与锥形瓶中的大理石接触后,有大量气泡产生,该反应的化学方程式是;C中观察到的现象是。
(2)用实验二进行石灰石性质的探究。
用两支坩埚钳分别夹持大小相同的石灰石固体d、e,向 E中酒精灯的火焰通氧气,受热相同时间后冷却,将固体d、e固体分别放入盛有酚酞溶液的烧杯中,前者溶液不变色,后者溶液变为红色。则向酒精灯火焰通氧气的目的是。通过上述实验对比分析,可得出的结论是。
(3)用实验三所示装置探究二氧化碳与氢氧化钠发生了反应。
①小军同学用实验三装置进行实验,分别量取50 mL水和氢氧化钙溶液放入F、G中,关闭K,通入约500 mL二氧化碳,观察到的现象F中无明显变化,G溶液变浑浊。这说明500mLCO2_______________溶于50mL水中(填是“部分”和“全部”)。
②小军同学用洗涤干净的实验三装置继续进行实验,分别量取50 mL氢氧化钠和氢氧化钙溶液放入F、G中,关闭K,通入约500 mL二氧化碳,F、G中均无明显变化。此实验可以说明二氧化碳和氢氧化钠发生了反应,其理由是____________________________________________________。
下图甲~丁是实验室制取氧气的装置图。
(1)写出仪器的名称:①、②。
(2)甲、乙装置都可用于实验室制氧气,用乙装置制氧气的优点是(填字母)。
A.节约能源 B.可较快获得氧气
C.可随时添加药品 D.操作简单、安全
(3)丙、丁装置都可用于实验室收集氧气。下面是对两种收集方法的相关比较(使用容积相同的集气瓶收集氧气)。
| 比较的方面 |
排水法 |
向上排气法 |
结论 |
| 方法可行性 |
O2难溶于水,且不与水反应。 |
O2的密度比空气_____(填“大”或“小”),且不与空气中的物质发生反应。 |
两种方法均可行。 |
| 收集O2的纯度 |
分别用排水法和向上排空气法收集两瓶氧气(A和B), 放入两支相同的蜡烛,可观察到B瓶内的蜡烛熄灭较早。 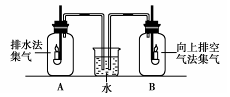 |
结论: _______________ _______________。 |
(6分)铜是人类最早利用的金属之一。
(1)下列铜制品中,利用金属导热性的是(填字母序号)。
A.铜质奖牌 B.铜导线C.铜火锅
(2)验证铜、银的活动性,可以选用的试剂是。
(3)利用废旧电池铜帽(含Cu、Zn)制取海绵铜(Cu),并得到硫酸锌溶液,主要流程如下(反应条件已略去): 已知:2Cu+2H2SO4+O2△2CuSO4+2H2O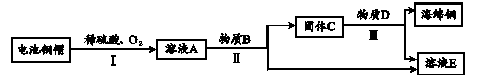
① 过程Ⅱ中分离操作的名称是。
② 过程Ⅲ中有气体产生,反应的化学方程式为。
溶液A中一定含有的溶质的物质有。