I.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等。按要求回答下列问题: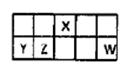
(1)写出X的原子结构示意图 。
(2)列举一个事实说明W非金属性强于Z 。
(3)含Y的某种盐常用作净水剂,其净水原理是 (用离子方程式表示)。
II.运用所学化学原理,解决下列问题:
(4)氰化物多数易溶于水,有剧毒,其中HCN是易挥发的弱酸,已知:Ka(HCN)=6.17x10-10。处理含CN-废水时,用NaOH溶液调节至pH=9时(常温),c(CN-) c(HCN)(填“>”、“<”或“=”)。
(5)已知:
①C(s)+O2(g)===CO2(g);△H ="a" kJ·mol-1;
②CO2(g) +C(s)===2CO(g);△H ="b" kJ·mol-1;
③Si(s)+ O2(g)===SiO2(s);△H ="c" kJ·mol-1。
工业上生产粗硅的热化学方程式为 。
(6)已知:CO(g)+H2O(g)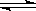 H2(g)+CO2(g)。下表为该反应在不同温度时的平衡常数。
H2(g)+CO2(g)。下表为该反应在不同温度时的平衡常数。
该反应的△H 0(填“>”、“<”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为 。
(7)一种新型氢氧燃料电池工作原理如下图所示。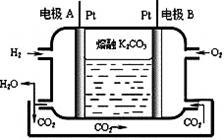
写出电极A的电极反应式 。
(1)在Cu+2H2SO4(浓)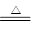 CuSO4+SO2↑+2H2O反应中,请用双线桥法标出元素化合价的升降、电子得失和被氧化、被还原的情况。
CuSO4+SO2↑+2H2O反应中,请用双线桥法标出元素化合价的升降、电子得失和被氧化、被还原的情况。
(2)维生素C能使食物中的Fe3+转化为Fe2+,即Fe3+ Fe2+
Fe2+
①在此变化中,Fe3+被_______(填氧化或还原,下同);维生素C是_______剂
②若有1molFe3+转化为Fe2+,则维生素C______(填得或失)_______mol电子
(1)写出下列离子方程式相应的化学方程式
①Ca2++CO32-=CaCO3↓化学方程式_____________
②Cu2++Fe ="Cu" +Fe2+化学方程式_____________
(2)鉴别饱和碳酸钠溶液和澄清石灰水,可选用的试剂有(填编号)________
A.盐酸 B.NaCl溶液 C.BaCl2溶液
下列物质:①H2O ②NaCl ③H2SO4④Ca(OH)2⑤Fe2O3⑥CuSO4·5H2O ⑦HNO3⑧AgNO3⑨NaHCO3其中属于氧化物的是________,属于碱的是________,属于酸的是________,属于盐的是______
用晶体的X射线衍射法对Cu的测定得到以下结果:Cu的晶胞为面心立方最密堆积(如右图),已知该晶体的密度为9.00 g·cm-3,晶胞中该原子的配位数为________;Cu的原子半径为________cm(阿伏加德罗常数为NA,列出计算表达式,不用化简)。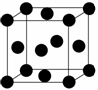
过渡元素在生活、生产和科技等方面有广泛的用途。
(1)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色,据此判断,[Mn(H2O)6]2+________(填“有”或“无”)颜色。
(2)现代污水处理工艺中常利用聚合铁{简称PFS,化学式为:[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子。下列说法中不正确的是________。(填序号)
| A.PFS中铁显+3价 |
| B.铁原子的外围电子排布式是3d64s2 |
| C.由FeSO4溶液制PFS需经过氧化、水解和聚合的过程 |
| D.由下表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难 |
| 元素 |
Mn |
Fe |
|
| 电离能 |
I1 |
717 |
759 |
| (kJ·mol-1)[ |
I2 |
1 509 |
1 561 |
| I3 |
3 248 |
2 957 |
(3)铬的配合物在药物应用、设计合成新磁材料领域和聚乙烯催化剂方面都有重要应用。现有铬(Ⅲ)与甲基丙烯酸根的配合物为:
①该化合物中存在的化学键类型有______________________________。
②甲基丙烯酸分子中C原子的杂化方式有________。
③等电子体是具有相同的价电子数和原子数的分子或离子,与H2O分子互为等电子体的微粒是________(填一种即可)。
④与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是________(填元素符号)。