(8分)甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)===2H2O(l) ΔH1=-571.8 kJ·mol-1;
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH2=-192.9 kJ·mol-1
(1)甲醇蒸气完全燃烧的热化学方程式为______________________________。
(2)反应②中的能量变化如图所示,则ΔH2=__________________。
(3)H2(g)的燃烧热为________________。
(4)请你分析H2(g)作为能源比甲醇蒸气作为能源的优点:
_____________________________________;________________________________(写出两点即可)。
(1)核素:人们把具有一定数目和一定数目的一种原子称为核素。
同位素:相同而不同的同一元素的不同原子互称为同位素。
(2)已知化学能与其他形式的能量能够相互转化:
二次电池充电是将转化为;
植物光合作用是将转化为。
(6分)(3)写出下列物质的电子式:
N2 H2O CaCl2
炭火炉内的炭燃烧至炽热时,在往炉膛底的热炭上喷洒少量水的瞬间,炉火更旺,这是因为。
如果烧去“同量的炭,喷洒过水和没有洒过水的炭火炉相比,放出的总能量(填“相同”或“不相同”),原因是 。
已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出14种元素的X的数值:
| 元素 |
H |
Li |
Be |
B |
C |
O |
F |
| X的数值 |
2.20 |
0.98 |
1.57 |
2.04 |
2.55 |
3.44 |
3.98 |
| 元素 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
| X的数值 |
0.93 |
1.31 |
1.61 |
1.90 |
2.19 |
2.58 |
3.16 |
试结合元素周期律知识完成下列问题:
(1)根据上表给出的数据,简述主族元素的X的数值大小与元素的金属性或非金属性强弱之间的关系___________________________;
(2)简述第二周期元素(除惰性气体外)的X的数值大小与原子半径之间的关系___________________________________。
(3)某化合物分子中含有S—N键,你认为该共用电子对偏向于_____原子(填元素符号)。
(4)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的化学键一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中的化学键类型是______________。
(5)上表中元素形成的AB型化合物中,离子性最强的是________。
由A、B元素组成的含4个原子核共42个电子的负二价阴离子中,每1个A的核内质子数比B的核内质子数多8个,试通过计算确定:
(1)A、B元素名称分别为____________和___________。
(2)写出该阴离子的离子符号________________。
(3)该阴离子与钠离子形成的化合物中含有__________键。
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: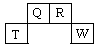
(1)T的原子结构示意图为 。
(2)元素的非金属性为(原子的得电子能力):Q W(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为 。
(4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是 。
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是 。