(共14分)乳酸亚铁([CH3CH(OH)COO]2Fe·3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe·3H2O+CO2↑。
已知FeCO3易被氧化:4FeCO3+6H2O+O2=4Fe(OH)3+4CO2
某兴趣小组用FeCl2(用铁粉和稀盐酸制得)和NH4HCO3制备FeCO3的装置示意图如下: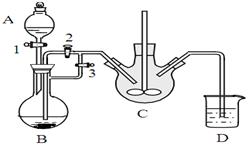
回答下列问题:
(1)NH4HCO3盛放在装置 中(填字母),该装置中涉及的主要反应的离子方程式 _
(2)将生成的FeCl2溶液和NH4HCO3溶液混合时的操作是 _
(3)将制得的FeCO3加入到足量乳酸溶液中,再加入少量铁粉,75℃下搅拌反应。铁粉的作用是 。反应结束后,无需过滤,除去过量铁粉的方法是 _
(4)该兴趣小组用KMnO4法测定样品中亚铁含量进而计算产品中乳酸亚铁的质量分数,发现产品的质量分数总是大于100%,其原因可能是 。
经查阅文献后,该兴趣小组改用铈(Ce)量法测定产品中Fe2+的含量。取2.880g产品配成100mL溶液,每次取20.00mL,进行必要处理,用0.1000mol·L-1Ce(SO4)2标准溶液滴定至终点,平均消耗Ce(SO4)2 19.70mL。滴定反应如下:
Ce4++Fe2+=Ce3++Fe3+
则产品中乳酸亚铁的质量分数为 _
(8分)有人设计了如图所示实验,以确认某混合气体中含有C2H4和SO2。
混合气体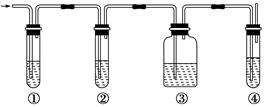
所需试剂有
| A.品红溶液 | B.NaOH溶液 | C.浓H2SO4 | D.酸性高锰酸钾溶液 |
试回答下列问题:
(1)写出图中①、②、③、④装置可盛放的试剂(将上述有关试剂的序号填入空格内):
①________,②________,③________,④________。
(2)使用装置②的目的是_____________________________________________________。
(3)确定乙烯存在的现象是____________________________________________________
(15分)某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.验证同周期主族元素金属性和非金属性的变化规律
(1)将钠、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果:
与盐酸反应最剧烈,与盐酸反应产生的气体最多。Al与HCl反应的离子方程式为_____
(2)向Na2S溶液中通入氯气出现现象,可证明Cl的非金属性比 S强,反应的离子方程式为。
Ⅱ.利用如图装置验证同主族元素非金属性的变化规律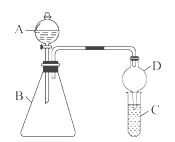
(3)仪器B的名称为,干燥管D的作用为防止。
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液的现象,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用溶液吸收尾气。
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液观察到C中溶液的现象即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有溶液的洗气瓶除去。
(14分)世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备ClO2的流程如下:
已知:①NCl3是黄色黏稠状液体或斜方形晶体,极易爆炸,有类似氯气的刺激性气味,自然爆炸点为95℃,在热水中易分解,在空气中易挥发,不稳定。②气体B能使湿润的红色石蕊试纸变蓝。
回答下列问题:
(1)电解时,发生反应的化学方程式为_____________________________________。实验室制备气体B的化学方程式为____________________________。为保证实验的安全,在电解时需注意的问题是:①控制好生成NCl3的浓度;②_______________________。
(2)NCl3与NaClO2(亚氯酸钠)按物质的量之比为1∶6混合,在溶液中恰好反应生成ClO2,该反应的离子方程式为_________________________________________ 。
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10 mL,稀释成100 mL试样;
步骤2:量取V1 mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30 min
步骤3:以淀粉溶液作指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知I2+2S2O32-=2I-+S4O62-)
①上述步骤3中滴定终点的现象是_______________________________;
②根据上述步骤可计算出原ClO2溶液的浓度为___________g/L(用含字母的代数式表示)。
(14分)过碳酸钠(2Na2CO3·3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下: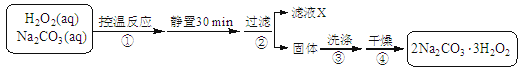
已知:主反应 2Na2CO3 (aq) + 3H2O2 (aq)  2Na2CO3·3H2O2 (s) ΔH < 0
2Na2CO3·3H2O2 (s) ΔH < 0
副反应 2H2O2 = 2H2O + O2↑
50°C时 2Na2CO3·3H2O2 (s) 开始分解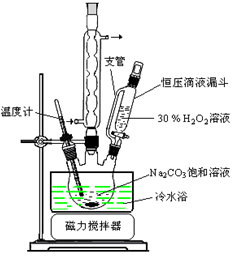
请回答下列问题:
(1)步骤①的关键是控制温度,原因是,其措施有、和。
(2)在滤液X中加入适量NaCl固体可析出过碳酸钠,原因是。
(3)步骤③中选用无水乙醇洗涤产品的目的是。
(4)下列物质中,会引起过碳酸钠失效的有。
| A.NaHCO3 | B.MnO2 | C.Na2SiO3 | D.Na2SO3 |
(5)过碳酸钠产品中往往含有少量碳酸钠,可用重量法测定过碳酸钠的质量分数;其操作步骤:取样品溶解→加入BaCl2溶液→ 过滤→ 洗涤→ 干燥→ 称量。需要直接测定的物理量有:(用字母表示并注明其含义).产品中过碳酸钠质量分数的表达式为:。
选考【化学——选修2:化学与技术】某工厂从废含镍有机催化剂中回收镍的工艺流程如图所示(已知废催化剂中舍有Ni70.0%及一定量的Al、Fe、SiO2和有机物,镍及其化台物的化学性质与铁的类似,但Ni2-的性质较稳定)。
已知:部分阳离子以氢氧化物的形式完全沉淀时的pH如下表所示,回答下列间题
(1)滤渣a的成分是________,用乙醇洗涤废催化剂的目的是________,从废渣中回收乙醇的方法是________。
(2)为提高酸浸速率,可采取的措施有(答两条)________________。
(3)向A中加人 H2O2时反应的离子方程式为__________.试剂x可以是________。
(4)用方程式表示出由沉淀。制取单质镍的方法_________、________。回收mkg上述废催化剂的过程中,若将溶液pH调整为6时消耗了a kgNi(OH)2,从洗涤到得到滤液B的过程中镍的损失率为3%,后几步操作过程中镍的损失率为5%,则最终得到单质镍的质量为________kg(填计算式)。
(5)利用化学镀(待镀件直接置于含有镀层金属的化合物的溶液中)可以在金属、塑料、陶瓷等物品表面镀上一层金属镍或铬等金属,某化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性条件下发生的反应之一如下,请配平该反应。
与电镀相比,化掌镀的最大优点是:________________________________。