(14分)过碳酸钠(2Na2CO3·3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下: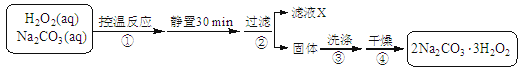
已知:主反应 2Na2CO3 (aq) + 3H2O2 (aq)  2Na2CO3·3H2O2 (s) ΔH < 0
2Na2CO3·3H2O2 (s) ΔH < 0
副反应 2H2O2 = 2H2O + O2↑
50°C时 2Na2CO3·3H2O2 (s) 开始分解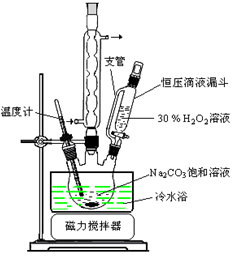
请回答下列问题:
(1)步骤①的关键是控制温度,原因是 ,其措施有 、 和 。
(2)在滤液X中加入适量NaCl固体可析出过碳酸钠,原因是 。
(3)步骤③中选用无水乙醇洗涤产品的目的是 。
(4)下列物质中,会引起过碳酸钠失效的有 。
| A.NaHCO3 | B.MnO2 | C.Na2SiO3 | D.Na2SO3 |
(5)过碳酸钠产品中往往含有少量碳酸钠,可用重量法测定过碳酸钠的质量分数;其操作步骤:取样品溶解→加入BaCl2溶液→ 过滤→ 洗涤→ 干燥→ 称量。需要直接测定的物理量有: (用字母表示并注明其含义).产品中过碳酸钠质量分数的表达式为: 。
将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
(1)下列说法正确的是____________。
| A.甲、乙均为化学能转变为电能的装置 |
| B.乙中铜片上没有明显变化 |
| C.甲中铜片质量减少、乙中锌片质量减少 |
| D.两烧杯中溶液的c(H+)均增小 |
(2)在相同时间内,两烧杯中产生气泡的速度:甲____乙(填“>”、“<“或“=”)。
(3)当甲中产生1.12L(标准状况)气体时,通过导线的电子数目为_______________。
(4)当乙中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为_________________ mol·L-1。
(5) 甲中锌片上发生的电极反应: _________________________;
(6) 若甲中两电极的总质量为60 g,工作一段时间后,取出锌片和铜片洗净干燥后称重,总质量为47 g,则:氢气的体积(标准状况)为________L。
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室也可以制取乙酸乙酯,并使用饱和碳酸钠溶液承接。回答下列问题:
(1)饱和碳酸钠溶液的主要作用是。
(2)写出乙醇具有下列性质的化学反应方程式
①制取乙酸乙酯。
②与金属钠反应。
③催化氧化生成乙醛。
(3) 生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度相等
⑥反应不再继续进行
[2012·天津卷]信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为_______________________________;得到滤渣1的主要成分为___________________。
(2)第②步加H2O2的作用是________________,使用H2O2的优点是
;调溶液pH的目的是使生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是。
(4)由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:
上述三种方案中,_______方案不可行,原因是_____________________________;从原子利用率角度考虑,________方案更合理。
(5)探究小组用滴定法测定CuSO4·5H2O (Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用cmol·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。滴定反应如下:
Cu2++H2Y2-=CuY2-+2H+
写出计算CuSO4·5H2O质量分数的表达式w= ________________ ;下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
[2012·云南省质检]用如图所示装置测定Fe和Fe2O3的混合物中单质铁的质量分数(夹持部分已略去)。称取Wg样品置于锥形瓶中,通过分液漏斗加入足量稀硫酸使样品完全溶解。实验前量气管起始读数为amL,实验后量气管的最终读数为bmL。
请回答下列问题:
(1)按上图完成装置连接,开始实验前必须进行的操作是。
(2)写出锥形瓶中发生化合反应的离子方程式:。
(3)实验结束后,锥形瓶内溶液中存在的金属离子有哪些可能?请根据选项进行填空(表格不一定填完):
| A.盐酸 | B.KSCN溶液 | C.酸性KMnO4溶液 | D.H2O2溶液 |
| 序号 |
溶液中可能存在 的金属离子 |
选择最少种数的试剂,验证该 假设(填字母) |
| ① |
||
| ② |
||
| ③ |
(4)实验中要对量气管多次读数,读数时应注意:①将实验装置恢复到室温;②;③视线与凹液面最低处相平。若读取量气管中气体的体积时,液面左高右低,则所测气体的体积(填“偏大”、“偏小”或“无影响’”)。
(5)若样品与足量稀硫酸反应后滴入KSCN溶液不显红色且量气管读数b>a(该实验条件下的气体摩尔体积为Vm)。下列有关单质铁质量分数的计算过程是否正确?(填“是”或“否”),理由是。
Fe+H2SO4=FeSO4+H2↑
56g VmL
Wg× (Fe) (b-a)×10-3L
(Fe) (b-a)×10-3L
……
[2012·漳州质检]2012年1月,广西河池龙江河段检测出重金属镉离子(Cd2+)含量超标,当地政府积极展开治污工作。聚合氯化铝可以将离子状态的镉固化,这是当前可采取治理镉污染的最有效方法。
已知:①煤矸石是煤矿在洗煤和选煤过程中大量排出的固体废弃物,煤矸石主要含Al2O3、SiO2及铁的氧化物。
②聚合氯化铝([Al2(OH)nCl6-n]m(1≤n≤5,m≤10),商业代号PAC)是一种新型、高效絮凝剂和净水剂。
以煤矸石为原料,采用铝盐水解絮凝剂,制得聚合氯化铝的工艺流程如下:
回答下列相关问题:
(1)向反应器中加入混合酸(20%的硫酸和盐酸)酸浸,其目的是。
(2)流程中残渣1可用于工业上制取粗硅,写出该反应的化学方程式。
(3)流程中残渣2的主要成分是,确认该成分中阳离子的方法是。
(4)聚合氯化铝除镉的原理是生成了氢氧化铝胶体吸附镉离子,确定已生成氢氧化铝胶体的方法可利用胶体性质中的。
常温下以溶液pH为横坐标,Cd2+离子的除去率为纵坐标,实验结果如图所示,由图可知,Cd2+离子的除去率最高时,溶液的c(OH-)=。