某同学将光亮的镁条放入滴有酚酞的NaHCO3饱和溶液中,产生大量气泡和白色固体,溶液红色加深。
一、溶液红色加深,则反应后溶液的碱性 (填“增强”、“不变”或“减弱”)。
二、为确定气体和固体的成分,该同学进行了如下的探究。
(1)点燃产生的气体,火焰淡蓝色;将燃烧产物通入澄清石灰水中,无现象。则该气体为 (写化学式)。
(2)对白色固体做出如下猜测并进行实验:
【猜测】
查阅资料1:Mg(HCO3)2能溶于水。
①白色固体可能是MgCO3;
② 白色固体可能是 ;
③白色固体可能是MgCO3和Mg(OH)2。
【实验】
① 取洗净后的白色固体,加入足量的 溶液,观察到 ,则白色固体一定含有MgCO3。
查阅资料2:MgCO3、Mg(OH)2加热易分解,分别生成两种氧化物。
②为进一步确定白色固体的组成,该同学进行了定量实验:
称取干燥的白色固体22.6 g,充分加热至不再产生气体为止,并使分解产生的气体全部先通过浓硫酸,浓硫酸增重1.8g,则白色固体中含有 ,再通过碱石灰,碱石灰增重8.8g,则固体中MgCO3与Mg(OH)2的质量比为 。
某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究。
【产品原理】
该厂采用“侯氏制碱法”生产化工产品——纯碱(Na2CO3)和化肥NH4Cl。
生产原理是:将NH3和CO2通入饱和食盐水中得到NaHCO3晶体和NH4Cl溶液,反应的化学方程式为: ;后分离出NaHCO3,加热制得纯碱。
【生产流程】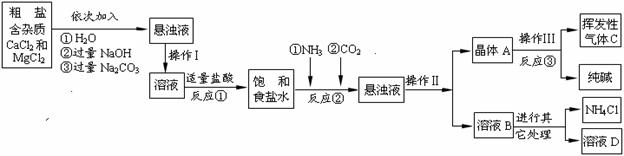
|
【相关资料】
⑴ NH4Cl| 物质 |
NaCl |
NaHCO3 |
NH4Cl |
NH3 |
CO2 |
| 溶解度 |
36.0g |
9.6g |
37.2g |
710 |
0.9 |
【问题讨论】
⑴操作Ⅰ、Ⅱ中,相同操作的名称为 。反应①中发生了两个反应,写出其中一个化学方程式: ,反应①加适量的盐酸,适量是指 。
⑵检验挥发性气体C的方法 。
⑶上述生产流程中可循环使用的是 (填序号)。
A.挥发性气体C B.溶液D C.氢氧化镁 D.化肥NH4Cl
【组成确定】
⑴称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
⑵另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀。由上述实验可确定纯碱样品含有杂质 (写化学式)。
【含量测定】
| 实验一 |
实验二 |
实验三 |
实验四 |
|
| 固体混合物溶液质量 |
100g |
100g |
100g |
100g |
| 加入CaCl2溶液质量 |
10g |
20g |
30g |
40g |
| 生成的沉淀的质量 |
4g |
m |
10g |
10g |
称取该纯碱样品44 g固体混合物,加水配成400g溶液,平均分为四份,然后分别加入一定质量分数的CaCl2溶液,实验数据见表:
请分析表中数据回答并计算:
⑴m= g;
⑵在实验三中,完全反应后所得溶液中溶质氯化钠的质量分数是多少?(要求写计算过程,结果保留0.1%)
【总结反思】
请通过计算并结合下表判断此纯碱样品等级为 品,在上述纯碱含量测定中,将CaCl2溶液改为BaCl2溶液,测定误差会减小。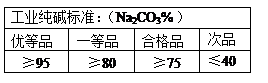
学习酸碱中和反应时,甲乙两同学对其产生探究兴趣。
⑴甲同学将固体氢氧化钠放入装有稀硫酸的试管中并振荡,试管壁发烫,于是他得出酸碱中和反应是放热反应的结论。乙同学认为甲同学推理不合理,理由是。
⑵乙同学为了验证甲同学的结论,将实验加以改进:将稀硫酸慢慢滴入装有氢氧化钠溶液的烧杯中,用温度计测出氢氧化钠溶液温度随加入稀硫酸质量的变化如图所示:
①由图知,稀硫酸与氢氧化钠溶液发生的反应是(填 “放热”或“吸热”)反应,B点表示的含义是。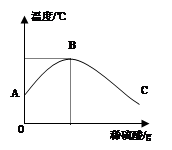
②从A到B过程中,烧杯中溶液pH逐渐。到达C时溶液中溶质有。
⑶丙同学将稀硫酸滴入氢氧化钠溶液中,有气泡产生,他认为氢氧化钠溶液已经变质。请你分析变质的原因(用化学方程式表示)。
⑷丁同学认为氢氧化钠溶液与稀硫酸混合没有明显现象,于是他想借助下列物质来验证反应是否真的发生,你觉得可行的是
| A.BaCl2 | B.pH试纸 | C.紫色石蕊溶液液 | D.无色酚酞溶液 |
小明对妈妈杀鱼时从鱼肚内取出的鳔产生了兴趣,他确定了“探究鳔内气体体积和成分”作为研究性学习的课题。小明通过查阅有关资料获知:这种鱼鳔内氧气约占1/4,其余主要是二氧化碳(二氧化碳能溶于水)和氮气。探究分两步进行。
(1)测量鳔内气体体积。小明设计了两种方法:
A.用医用注射器抽取鳔内气体,测量其体积;
B.在水下剌破鳔,用排水集气法收集鳔内气体并测量其体积(如图)。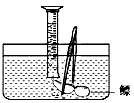
你认为两种方法中合理的是;
(2)探究鳔内气体的成分。给你两集气瓶的鳔内气体,请你帮助他设计实验验证假设。
| 验证 |
方法 |
现象 |
| 鳔内含O2 |
||
| 鳔内含CO2 |
某化学兴趣小组对教材中“测定空气里氧气含量”的实验(见图I)进行了大胆改进,设计图(Ⅱ)(选用容积为45mL的18×180mm的试管作反应容器)实验方案进行,收到了良好的效果。请你对比分析下面图I、图Ⅱ实验,回答下列有关问题:
(1)按图I所示装置进行实验,红磷在瓶中燃烧时的主要现象是①;发生反应的文字表达式为②。若止水夹未夹紧,会导致测定结果_____③________(填“偏小”、“偏大”或“不变”,下同);若图Ⅰ中集气瓶口漏气,会导致测定结果④。
(2)按图Ⅱ所示装置进行实验
①实验前,打开弹簧夹,将注射器的活塞前沿从20 mL刻度处推至15mL刻度处,然后松手,若活塞仍能返回至20mL刻度处,则说明。
②按图Ⅱ实验时的操作步骤如下:
a、读取注射器活塞的数据。 b、撤去酒精灯,待试管冷却到室温后松开弹簧夹。
c、将少量红磷平装入试管中,将20mL的注射器活塞置于15mL刻度处,并按图Ⅱ中所示的连接方式固定好,再将弹簧夹紧橡皮管。d、点燃酒精灯。e、检查装置的气密性。
你认为正确的实验操作顺序是(填序号)。
③当红磷与氧气充分反应后,移开酒精灯并打开弹簧夹,注射器活塞将从15mL刻度处慢慢前移到约为mL刻度处才停止。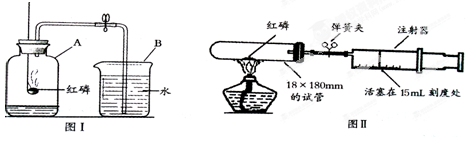
以下是某研究小组探究影响反应速率部分因素的相关实验数据。
| 实验序号 |
H2O2溶 液浓度% |
H2O2溶液体积/mL |
温度℃ |
MnO2的用量/g |
收集氧气的体积/mL |
反应所需 的时间/s |
| ① |
5 |
1 |
20 |
0.1 |
4 |
16.75 |
| ② |
15 |
1 |
20 |
0.1 |
4 |
6.04 |
| ③ |
15 |
1 |
20 |
0 |
4 |
96.50 |
| ④ |
30 |
5 |
35 |
0 |
2 |
49.21 |
| ⑤ |
30 |
5 |
55 |
0 |
2 |
10.76 |
(1)通过实验①和②对比可知,化学反应速率与有关;
(2)从实验和对比可知,化学反应速率与温度的关系是:;
(3)通过实验②和③比较可知,使用对化学反应速率影响很大。
(4)用一定量15%的过氧化氢溶液制氧气,为了减缓反应速率,可加适量的水稀释,产生
氧气的总重量(选填“减小”或“不变”或“增大”)。