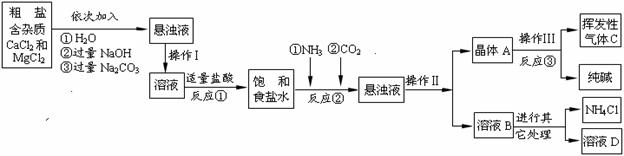
某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究。
【产品原理】
该厂采用“侯氏制碱法”生产化工产品——纯碱(Na2CO3)和化肥NH4Cl。
生产原理是:将NH3和CO2通入饱和食盐水中得到NaHCO3晶体和NH4Cl溶液,反应的化学方程式为: ;后分离出NaHCO3,加热制得纯碱。
【生产流程】
|
【相关资料】
⑴ NH4Cl| 物质 |
NaCl |
NaHCO3 |
NH4Cl |
NH3 |
CO2 |
| 溶解度 |
36.0g |
9.6g |
37.2g |
710 |
0.9 |
【问题讨论】
⑴操作Ⅰ、Ⅱ中,相同操作的名称为 。反应①中发生了两个反应,写出其中一个化学方程式: ,反应①加适量的盐酸,适量是指 。
⑵检验挥发性气体C的方法 。
⑶上述生产流程中可循环使用的是 (填序号)。
A.挥发性气体C B.溶液D C.氢氧化镁 D.化肥NH4Cl
【组成确定】
⑴称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
⑵另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀。由上述实验可确定纯碱样品含有杂质 (写化学式)。
【含量测定】
| |
实验一 |
实验二 |
实验三 |
实验四 |
| 固体混合物溶液质量 |
100g |
100g |
100g |
100g |
| 加入CaCl2溶液质量 |
10g |
20g |
30g |
40g |
| 生成的沉淀的质量 |
4g |
m |
10g |
10g |
称取该纯碱样品44 g固体混合物,加水配成400g溶液,平均分为四份,然后分别加入一定质量分数的CaCl2溶液,实验数据见表:
请分析表中数据回答并计算:
⑴m= g;
⑵在实验三中,完全反应后所得溶液中溶质氯化钠的质量分数是多少?(要求写计算过程,结果保留0.1%)
【总结反思】
请通过计算并结合下表判断此纯碱样品等级为 品,在上述纯碱含量测定中,将CaCl2溶液改为BaCl2溶液,测定误差会减小。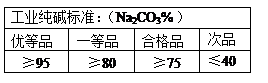
同学们在学习了木炭还原氧化铜的实验后,联想到单质碳的一些化学性质,对反应后的气体成分产生了疑问,某学习小组对该反应产物中的气体成分进行了探究。
〔猜 想〕
①气体产物全部是CO2②气体产物全部是CO③气体产物
〔查阅资料〕 CO气体能使湿润的黄色氯化钯试纸变蓝色。
〔设计实验〕根据各自的猜想,他们共同设计了如下图的实验装置进行探究。
〔现象与分析〕
| 现象 |
结论 |
| 如果装置B, 装置C无现象 |
则猜想①成立 |
| 如果装置B无现象,装置C |
则猜想②成立 |
| 如果装置B,装置C____________ |
则猜想③成立 |
〔结论〕实验现象证明猜想③成立,同学们的疑问是合理的。
〔反思〕
(1)同学们对CO产生的原因进行了分析:
①原因一:木炭和氧化铜在高温条件下直接发生反出产生CO;
②原因二:反应C+2CuO 2Cu+CO2↑中的一种产物和反应物木炭又发生了化学反应,产生了CO;
2Cu+CO2↑中的一种产物和反应物木炭又发生了化学反应,产生了CO;
请你从原因一、原因二中选择其一,用化学方程式表示存在此原因的化学反应原理______________________________________________。
(2)根据上述实验,请你归纳出单质碳在工业上的重要用途
小红同学想探究实验室中碳酸钙和盐酸制取二氧化碳后废液中溶质的成分,请你一同参与探究并回答横线上的七个问题。
【提出问题】废液中的溶质是什么物质?
【作出猜想】小红认为废液中溶质只有CaCl2。
你认为还可能含有的溶质是 (填化学式)。
【查阅资料】CaCl2溶液呈中性。
【实验与结论】
(1)请你写出碳酸钙和盐酸反应的化学方程式 。
(2)分别取少量该废液和CaCl2溶液加入到两支试管中,并向其中分别滴入无色酚酞试液做对比试验,结果两支试管中溶液均无色,于是小红认为自己的猜想是正确的。
(3)你认为小红的实验 (填“能”或“不能”)证明她的猜想,理由是
。
(4)如果要证明你的猜想是正确的,你选择 (填字母:A、石蕊试液 B、氢氧化钠溶液 C、 稀盐酸 )来代替酚酞试液,理由是。
(5)若实验证明了你的猜想是正确的,向废液中加入过量的 ,反应完成后过滤就可得到只含CaCl2一种溶质的溶液。
下列装置常用于实验室制取气体。根据给出的装置回答下列问题:
(1)指出编号仪器名称:①;②。
(2)实验室利用A装置制取氧气,反应原理用化学方程式表示为。利用C装置收集氧气的最佳时刻是。
(3)制取并收集二氧化碳应选择的装置是(从A——E中选择),使用该套装置制取气体的突出优点是。
(4)若改用F装置收集二氧化碳,则气体应从端进入。
若要制得的干燥的二氧化碳应选取上图中的装置(从G、H 中选择),并且气体从(用端口字母表示)进入。若要检验收集到的气体是否为二氧化碳气体,方法是
原理是(用化学方程式表示)。
某化学学习小组为比较镁和铝的金属活动性强弱设计了如下实验方案。
(1)实验准备:(1)用98%的浓硫酸配制l0%的硫酸溶液。现有烧杯、玻璃棒、量筒, 还需要的仪器有;
【方案一】在等质量的镁条和铝片的两支试管中,分别与相同体积相同质量分数的硫酸反应,观察到镁比铝反应更剧烈,说明。
[反思]:有的同学认为这种方案不够合理,理由是_________________________________。
【方案二】(1)连接仪器组装成如右图所示实验装置。某学生用抽拉法检查该装置的气密性,发现被拉出的针筒活塞一段时间后又回到原来的位置,你认为该装置是否漏气?。
(2)依次进行镁、铝与硫酸反应,写出镁与硫酸反应的化学方程式:;
要比较两种金属活动性强弱,可以测定两种金属硫酸反应得到相同体积氢气所需要的时间;还可测定。
[拓展] 镁与铝分别与足量的质量分数为l0%稀硫酸反应,如制得相同质量的氢气,则镁与铝的质量比为。(2分)
【方案三】请设计一个与上述实验不同的方案,比较镁和铝的金属活动性强弱:
高温下赤热的焦炭能与水蒸气发生反应生成无色的气体,探究小组同学对其反应后生成的气体作了如下探究:
【猜想与假设】假设①:生成的气体可能有H2、CO;
假设②:生成的气体可能有H2、CO2、;
假设③:生成的气体可能有H2、CO、CO2、N2;
假设④:……
探究小组组长认为③的猜想不合理,他作出判断的理论依据是
。
【设计与实验】为了证明他们的猜想是正确的,设计了如下图所示的实验装置:
提示: 浓硫酸作干燥剂,无水硫酸铜遇到水变蓝色,H2和CuO反应生成Cu和H2O,CO与CuO反应的原理与工业炼铁的反应原理相似。)
① 证明混合气体中含有H2,相应的反应现象是
;
② 证明混合气体中含有CO,相应的反应现象是
;
③ 证明混合气体中含有CO2,相应的反应现象是
。
【结论与思考】实验后得出结论,假设①成立。
① 写出焦炭与水蒸气发生反应的化学方程式;
② 有同学认为尾气直接排出会污染空气,应如何处理更合理:
。