【化学一选修化学与技术】印尼火山喷发不仅带来壮观的美景,还给附近的居民带来物质财富,有许多居民冒着生命危险在底部的火山口收集纯硫磺块来赚取丰厚收入。硫磺可用于生产化工原料硫酸。某工厂用下图所示的工艺流程生产硫酸:
请回答下列问题:
(1)为充分利用反应放出的热量,接触室中应安装 (填设备名称)。吸收塔中填充有许多瓷管,其作用是 。
(2)为使硫磺充分燃烧,经流量计1通入燃烧室的氧气过量50%,为提高 转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为 。假设接触室中
转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为 。假设接触室中 的转化率为95%,b管排出的尾气中二氧化硫的体积分数为 (空气中氧气的体积分数按0.2计),该尾气的处理方法是 。
的转化率为95%,b管排出的尾气中二氧化硫的体积分数为 (空气中氧气的体积分数按0.2计),该尾气的处理方法是 。
(3)与以硫铁矿为原料的生产工艺相比,该工艺的特点是 (可多选)。
A.耗氧量减少 B.二氧化硫的转化率提高
C.产生的废渣减少 D.不需要使用催化剂
(4)硫酸的用途非常广,可应用于下列哪些方面 。
A.橡胶的硫化 B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产 D.过磷酸钙的制备
(5)矿物燃料的燃烧是产生大气中 的主要原因之一。在燃煤中加入适量的石灰石,可有效减少煤燃烧时
的主要原因之一。在燃煤中加入适量的石灰石,可有效减少煤燃烧时 的排放,请写出此脱硫过程中反应的化学方程式 。
的排放,请写出此脱硫过程中反应的化学方程式 。
高中化学学习阶段,氨的催化氧化反应也可用某金属M(相对原子质量<100)的氧化物做催化剂。M元素的离子在一定条件下能与NH3、卤离子等按某固定比例牢牢结合成稳定的配合物离子(类似于原子团)。
(1)150℃、常压下,6.08g该氧化物与0.6mol HCl气体充分发生复分解反应后,氧化物无剩余,气体变为0.48mol。该金属M的相对原子质量为___________。
将上述反应所得固体溶于水配成50.0mL溶液,该溶液中溶质的物质的量浓度为
_______mol·L-1。
(2)取(1)中所配溶液12.5mL,稀释至25mL,缓缓通入2688mL氨气(标况下),在一定条件下反应恰好完全,得到产物B(摩尔质量为260.5g/mol),继续用1.5mol/L的AgNO3溶液滴定,达到终点时,耗去AgNO3溶液40.0mL。将B投入过量烧碱溶液中,未检测出NH3的逸出。则B的化学式可表示为。
(3)已知在下图中,L的位置完全相同。现有另一种配离子[M(NH3)6-xClx]n±(1≤x≤5,且x为整数),结构类似下图。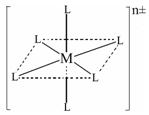
如果该配离子共有2种不同结构,该配离子的式量为。
(4)一定条件下,3.04g该金属氧化物恰好被某氧化剂(效果相当于0.03mol O2)氧化,再加入0.05mol KCl,经一些特殊工艺处理,K、M两元素恰好完全形成含氧酸盐(式量<360),且盐内部阴阳离子个数比为1:2。则该盐的式量以及物质的量分别为_______________。
A、B、C、D、E、F、G、H、I、J 均为有机化合物,其转化关系如下图所示。已知B 和 C 均为有支链的有机化合物;C在反应③中只能生成一种有机产物;G 能使溴的四氯化碳溶液褪色。回答问题:
能使溴的四氯化碳溶液褪色。回答问题:
(1)G的结构简式:____________________。⑦的反应类型____________________。
(2)步骤⑤的化学方程式 ______________________________________________。
(3)A在隔绝加热条件下可发生消去反应得到D ,请写出该消去反应中除D外的另一个产物的结构简式__________________________。
,请写出该消去反应中除D外的另一个产物的结构简式__________________________。
(4)步骤④中的“Cl2、光”能否改为“饱和氯水”?请说明原因:__________
(5)写出与H 具有相同官能团的同分异构体的结构简式______________________
(6)在一定条件下,酯与醇会发生酯交换,生成新的酯和醇。请尝试书写I与F发生的酯交换反应方程式:_____________________________________________________。
(7)一定条件下,G和H发生1:1聚合,聚合产物有多种。写 出其中两种聚合产物的结构简式:____________________________________________________________。
出其中两种聚合产物的结构简式:____________________________________________________________。
已知烃基烯基醚水解反应:R-CH=CH-O-R′ 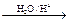 R-CH2CHO + R′OH。烃基烯基醚A的式量为176,分子中碳氢原子数目比为3∶4 。有机物B的式量为60。相关的反应如下。请回答下列问题:
R-CH2CHO + R′OH。烃基烯基醚A的式量为176,分子中碳氢原子数目比为3∶4 。有机物B的式量为60。相关的反应如下。请回答下列问题: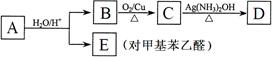
⑴ A的结构简式为________________________,B的名称是___________________。
⑵写出B → C反应的化学方程式:________________ _______________________。
_______________________。
⑶写出两种符合下列条件的E的同分异构体的结构简式:__ ___________________。
___________________。
① 属于芳香醛; ② 苯环上有两种不同的氢原子。
⑷由E转化为对甲基苯乙炔(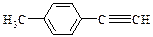 )的一条路线如下:
)的一条路线如下: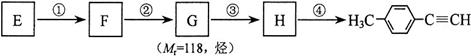
(I)写出G的结构简式:_____________________________。
(II)步骤②所加试剂及反应条件为:____________。步骤④的反应类型为:________。
固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g) CH3OH(g)+H2O(g)+ 49kJ
CH3OH(g)+H2O(g)+ 49kJ
某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。a,b,c,d括号内数据表示坐标。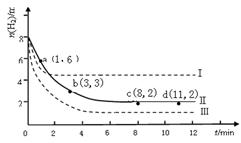
(1)a点正反应速率_______(填大于、等于或小于)逆反应速率。
(2)下列时间段平均反应速率最大的是___________。
A.0~1min B.1~3min C.3~8min
(3)仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是___________,曲线III对应的实验条件改变是_________。
(4)比较以上三种不同状态下的平衡常数大小(用KⅠ、KⅡ、KⅢ表示)。
(5)若在开始时,科学实验将3molCO2和4molH2充入2L的密闭容器中,其他条件不变,达平衡后氢气的物质的量n1mol(填大于,小于或等于)。
已知:还原性HSO3->I-,氧化性IO3-> I2 。
(1)在NaIO3溶液中滴加少量NaHSO3溶液,发生下列反应。配平反应方程式并标出电子转移的方向和数目。
囗NaIO3+囗NaHSO3 → 囗I2+囗Na2SO4+囗H2SO4+囗H2O
(2)在NaIO3溶液中滴加过量NaHSO3溶液,反应完全后,推测反应后 溶液中的还原产物为_________(填化学式);
溶液中的还原产物为_________(填化学式);
(3)在含5molNaHSO3的溶液中逐滴加入NaIO3溶液。加入NaIO3的物质的量和析出I2单质的物质的 量的关系曲线如图所示。写出反应过程中与AB段曲线对应的离子方程式__________________________;当溶液中I-与I2的物质的量之比为5:3时,加入的NaIO3为mol。
量的关系曲线如图所示。写出反应过程中与AB段曲线对应的离子方程式__________________________;当溶液中I-与I2的物质的量之比为5:3时,加入的NaIO3为mol。