X、Y、Z、W是原子序数依次增大的前四周期元素,X元素原子核外有三个能级,各能级电子数相等,Y的单质在空气中燃烧生成一种淡黄色的固体;Z元素原子的最外层电子数比次个层电子少数2,W的内层电子已充满,最外层只有一个电子。请回答:
(1)X元素在周期表中的位置是 ;W2+离子的核外电子排布式
(2)Y离子和Z离子比较,半径较大的是 (写离子符号),Z元素和氧元素的简单气态氢化物沸点不同的原因是
(3)Z元素的非金属性比 强,可由一复分解反应推测而得,其反应的化学方程式为
(4)X单质易溶于X与Z形成的三原子化合物中,该化合物分子中的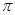 键与
键与 键的个数之比是 ;Y元素最高价氧化物对应水化物与小苏打反应的离子方程式为
键的个数之比是 ;Y元素最高价氧化物对应水化物与小苏打反应的离子方程式为
(5)用H2O2和Z元素最高价氧化物对应水化物的混合溶液可溶解W单质粉末,已知:
①W(s)+2H+(aq)=W2+(aq)+H2(g) ∆H=-64.39KJ/mol
②2H2O2(l)=2H2O(l)+O2(g)∆H=-196.46KJ/mol
③H2(g)+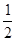 O2(g)= H2O(l) ∆H=" -285.84" KJ/mol
O2(g)= H2O(l) ∆H=" -285.84" KJ/mol
则在Z元素最高价氧化物对应水化物的溶液中,W与H2O2反应生成W2+与H2O的热反应化学方程式为
[物质结构]X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;Z基态原子的M层与K层电子数相等;R2+的3d轨道有9个电子。
请回答下列问题:
(1)Y基态原子的电子排布式是;
(2)Z所在周期中第一电离能最大的主族元素是。
(3)XY2—的立体构型是;
(4)Z与某元素形成的化合物的晶胞如图所示,晶胞中阴离子与阳离子的个数比是。
(5)将R单质的粉末加入X气态氢化物的浓溶液中,不断鼓入空气充分反应,得到深蓝色的[R(NH3)4](OH)2溶液,该反应的离子方程式是;1mol [R(NH3)4]2+中含有的σ键的数目是。
氮及其化合物的转化是资源利用和环境保护的重要研究课题,下面是氮的氧化物的几种不同情况下的转化。
(1)已知:2SO2(g)+ O2 (g) 2SO3 (g) △H =-196.6kJ·mol-1
2SO3 (g) △H =-196.6kJ·mol-1
2NO(g)+ O2 (g)  2NO2 (g) △H =-113.0kJ·mol-1
2NO2 (g) △H =-113.0kJ·mol-1
则SO2气体与NO2气体反应生成SO3气体和NO气体的反应为(填“放热”或“吸热”)反应。
(2)向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g) SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。
①反应在c点(填“达到”或“未到”)平衡状态。
②开始时,在该容器中加入:
I:1molSO2(g)和1molNO2(g);
II:1molSO3(g)和1mol NO(g),
则达化学平衡时,该反应的平衡常数III(填“>”、“=”或“<”)。
(3)用氢氧化钠溶液吸收氮的氧化物时发生下列反应:
2NaOH + NO + NO2 = 2NaNO2 + H2O
2NaOH + 2NO2 = NaNO2 + NaNO2 + H2O
将反应混合液和氢氧化钠溶液分别加到下图所示的电解槽中进行电解,A室产生了N2。
①电极Ⅰ是极,B室产生的气体是。
②A室NO2-发生的电极反应是。
(4)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。现有NO、NO2的混合气6 L,可用同温同压下7 L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为。
聚合硫酸铝铁[AlaFeb(OH)m(SO4)n·xH2O] 是一种新型高效净水剂,广泛应用于工业污染水的处理。
(1)聚合硫酸铝铁能够净水的原因是。
(2)AlaFeb(OH)m(SO4)n·xH2O中a、b、m、n的代数关系式为。
(3)为了测定聚合硫酸铝铁的组成,进行如下实验:
步骤一:准确称取8.810 g样品溶于150mL 0.100mol·L-1稀硫酸,恰好完全反应后,加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体10.485g;
步骤二:另取相同质量的样品,溶于过量的氢碘酸,以磁力搅拌机搅拌,充分反应后,以0.500 mol·L-1Na2S2O3溶液滴定至浅黄色,滴入几滴淀粉溶液,再滴定至终点,消耗Na2S2O3溶液20.00mL。(已知:I2+2Na2S2O3=2NaI+Na2S4O6)
①步骤二中使用磁力搅拌器进行搅拌的目的是。
②通过计算确定聚合硫酸铝铁的化学式(写出计算过程)。
(本题15分)卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)溴的基态原子的价电子排布图为___________。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是____________。
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是___________。
| 元素名称 |
氟 |
氧 |
溴 |
碘 |
铍 |
| 第一电离能(kJ/mol) |
1681 |
1251 |
1140 |
1008 |
900 |
(4)已知高碘酸有两种形式,化学式分别为H5IO6( )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、“<”或“=”)
(5)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大,这是由于溶液中发生下列反应:I-+I2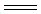
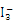 。
。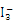 的中心原子周围的σ键电子对对数为__________,孤电子对对数为_________。
的中心原子周围的σ键电子对对数为__________,孤电子对对数为_________。
(6)写出一个ClO2-的等电子体:_________________。
(本题13分)Ⅰ. 在一定温度下,将2molA和2molB两种气体相混合后于容积为2L的某密闭容器中,发生如下反应3A(g)+B(g) 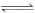 xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x值等于________________。
(2)A的转化率为_________________。
(3)生成D的反应速率为_________________。
(4)如果增大反应体系的压强,则平衡体系中C的质量分数 _________。
(5)如果上述反应在相同条件下从逆反应开始进行,开始加入C和D各mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入________物质_________mol。
Ⅱ.恒温下,将amol N2与bmol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:
N2(g)+3H2(g) 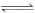 2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,则a=。
(2)反应达平衡时,混合气体的体积为716.8 L(标准状况下),其中NH3的体积分数为25%。则平衡时NH3的物质的量为。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始):n(平)=____________________________。
(4)达到平衡时,N2和H2的转化率之比,α(N2)∶α(H2)=________。