氮及其化合物的转化是资源利用和环境保护的重要研究课题,下面是氮的氧化物的几种不同情况下的转化。
(1)已知:2SO2(g)+ O2 (g) 2SO3 (g) △H =-196.6kJ·mol-1
2SO3 (g) △H =-196.6kJ·mol-1
2NO(g)+ O2 (g)  2NO2 (g) △H =-113.0kJ·mol-1
2NO2 (g) △H =-113.0kJ·mol-1
则SO2气体与NO2气体反应生成SO3气体和NO气体的反应为 (填“放热”或“吸热”)反应。
(2)向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g) SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。
①反应在c点 (填“达到”或“未到”)平衡状态。
②开始时,在该容器中加入:
I:1molSO2(g)和1molNO2(g);
II:1molSO3(g)和1mol NO(g),
则达化学平衡时,该反应的平衡常数I II(填“>”、“=”或“<”)。
(3)用氢氧化钠溶液吸收氮的氧化物时发生下列反应:
2NaOH + NO + NO2 = 2NaNO2 + H2O
2NaOH + 2NO2 = NaNO2 + NaNO2 + H2O
将反应混合液和氢氧化钠溶液分别加到下图所示的电解槽中进行电解,A室产生了N2。
①电极Ⅰ是 极,B室产生的气体是 。
②A室NO2-发生的电极反应是 。
(4)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。现有NO、NO2的混合气6 L,可用同温同压下7 L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为 。
在一定条件下,反应A(气)+B(气) C(气)(正反应为放热反应)达到平衡后,根据下列图象判断:
C(气)(正反应为放热反应)达到平衡后,根据下列图象判断: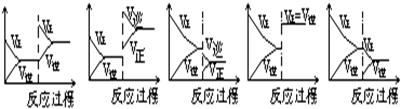
| A. | B. | C. | D.E. |
(1)升温,达到新的平衡的是( );(2)降压,达到新的平衡的是( );(3)减少C的量,移向新平衡的是();(4)增加A的量,移向新平衡的是();(5)使用催化剂,达到平衡的是( )。
在一定体积的密闭容器中,进行如下反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
⑴该反应化学平衡常数的表达式:K=;
⑵该反应为(填“吸热”或“放热”)反应;
⑶下列说法中能说明该反应达平衡状态的是
A、容器中压强不变 B、混合气体中c(CO)不变
C、混合气体的密度不变 D、c(CO) = c(CO2)
E、化学平衡常数K不变 F、单位时间内生成CO的分子数与生成H2O的分子数相等
⑷某温度下,各物质的平衡浓度符合下式:c(CO2)×c(H2)=c(CO)×c(H2O),试判此时的温度为。
化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。下图为N2(g)和O2(g)生成NO(g)过程中的能量变化
(1)人们通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,则N≡N的键能为___________ kJ/mol,由上图写出N2(g)和O2(g)生成NO(g)的热化学反应方程式_______________________
(2)根据下列反应的热化学反应式,计算由C(石墨)和H2(g)反应生成1mol C2H2(g)的△H。
C(石墨) + O2(g) = CO2(g);△H1 =" -" 393.5 kJ/mol
2H2(g) + O2(g) = 2H2O(l);△H2 =" -" 571.6 kJ/mol
2C2H2(g) + 5 O2(g) = 4CO2(g) + 2H2O(l);△H3 =" -" 2599.2 kJ/mol,
则由C(石墨)和H2(g)反应生成1mol C2H2(g)的△H _______________________ kJ/mol。
已知稀的酸与稀的碱发生中和反应,生成1mol水所放出的热叫中和热,用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: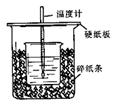
(1)从实验装置上看,图中尚缺少的一种玻璃用品是。
(2)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等、不相等”),所求中和热(填“相等、不相等”),
(3)已知滇池中学高二一班某同学的实验记录如下,
| 实验次数 |
酸的温度 |
碱的温度 |
反应最高温度 |
| 1 |
21.5℃ |
20.5℃ |
24.3℃ |
| 2 |
21.5℃ |
21.5℃ |
25.0℃ |
| 3 |
16.0℃ |
18.5℃ |
21.5℃ |
请根据有用数据计算中和热(酸碱的密度均视为1g/ml, C=4.17J/g.℃)
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会;(填“偏大”、“偏小”、“无影响”)。
部分中学化学常见元素原子结构及性质如下表所示:
| 序 号 |
元素 |
结构及性质 |
| ① |
A |
在地壳中的含量居于第三位,单质由电解法制取,其化学性质活泼,但在空气中能稳定存在;其离子半径在同周期中金属离子中最小。 |
| ② |
B |
B原子最外层电子数是内层电子数的1/5 |
| ③ |
C |
C单质分子中含化学键数最多,单质稳定,但其原子较活泼 |
| ④ |
D |
通常情况下,D没有正化合价,A、B、C、E都能与D化合 |
| ⑤ |
E |
E在周期表中可以排在IA族,也有人提出排在ⅦA族、ⅣA族 |
(1)上述元素中,其最高价氧化物对应的水化物呈两性的物质是_____________(填化学式),试用离子反应方程式表示其两性的原因___________________________________________;
_________________________________________________。
(2)B与C简单离子的半径大小为_________________(用离子符号表示)
(3)E与D可以按原子个数比2:1、1:1形成两种化合物X、Y,写出一定条件下X与B反应的方程式为,E与C组成的两种化合物M、N,所含电子数分别与X、Y相等,请写出M的电子式,N的结构式 ___ __