工业上由焦炭或夭然气制氢气的过程中会产生一氧化碳。为了除去氢气中混有的一氧化碳,可在催化剂存在的条件下将一氧化碳与水蒸气发生反应:
CO(g)+H2O(g)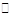 CO2(g)+H2(g) △H="-41.0" kJ·mol-l .
CO2(g)+H2(g) △H="-41.0" kJ·mol-l .
该反应在工业上被称为“一氧化碳变换”。
(1)写出该反应的平衡常数表达式:K= ;K ( 200℃) K ( 300℃) (填 “>”、“=”或“<”)。
(2)在773K时,一氧化碳发生反应的平衡常数K=9,如反应开始时CO和H2O的浓度都是0.020·mol-l ,则在此反应条件下一氧化碳的转化率为 。
(3)某工业合成氨的原料气组成为:H2 40%、N2 20%、CO30%、CO210%(均为体积分数)。现采用“一氧化碳变换”法,向上述原料气中加入水蒸气,以除去其中的CO。已知不同温度及反应物投料比( )下,变换后平衡混合气体中CO的体积分数如下表所示:
)下,变换后平衡混合气体中CO的体积分数如下表所示:
| CO的体积分数/% 投料比 温度/℃ |
 =1 =1 |
 =3 =3 |
 =5 =5 |
| 200 |
1.70 |
0.21 |
0.02 |
| 250 |
2.73 |
0.30 |
0.06 |
| 300 |
6.00 |
0.84 |
0.43 |
| 350 |
7.85 |
1.52 |
0.80 |
①从表中数据可以得到控制不同条件时CO的转化率的变化规律。能使CO的转化率升高,可改变的条件是 、 。
②温度是一氧化碳变换工艺中最重要的工艺条件,实际生产过程中将温度控制在300℃左右,其原因是 。
③温度为300℃、 =1时,反应后的平衡混合气体中CO2的体积分数是 。(结果保留3位有效数字)o
=1时,反应后的平衡混合气体中CO2的体积分数是 。(结果保留3位有效数字)o
右图为实验室某浓盐酸试剂瓶上的标签,
试根据有关数据回答下列问题:
(1)该浓盐酸的物质的量浓度为___________mol/L。
(2)某学生欲用上述浓盐酸和蒸馏水配制250 mL物质的量浓度为0.7 mol/L稀盐酸。
①该学生用量筒量取________ mL上述浓盐酸进行配制;
②所需的实验仪器有:①胶头滴管、②烧杯、③量筒、④玻璃棒,配制稀盐酸时,还缺少的仪器有 。
③下列操作导致所配制的稀盐酸的物质的量浓度偏低的是 (填字母)。
| A.用量筒量取浓盐酸时俯视凹液面 |
| B.未恢复到室温就将溶液注入容量瓶并进行定容 |
| C.容量瓶用蒸馏水洗后未干燥 |
| D.定容时仰视液面 |
E、未洗涤烧杯和玻璃棒
(3)若在标准状况下,将a L HCl气体溶于1 L水中,所得溶液密度为d g/mL,则此溶液的物质的量浓度为 mol/L。
a.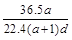 b.
b.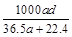 c.
c. d.
d.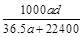
电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。用FeCl3溶液做腐蚀液与Cu反应生成CuCl2和FeCl2。
(1)写出该反应的化学方程式 。
(2)印刷电路的废腐蚀液含有大量CuCl2、FeCl2、FeCl3,任意排放会造成环境污染及资源的浪费。通过下列流程可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。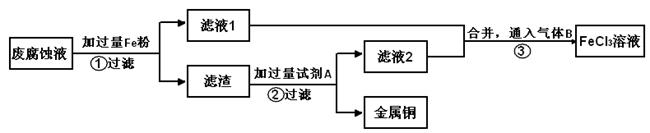
学科Ⅰ、步骤②需加入的试剂A是 (填化学式);
Ⅱ、步骤③通入的气体B是 (填化学式),写出该反应的离子方程式: 。
分析下列反应:3S+6 KOH = 2K2S+K2SO3+3H2O,据此作答:
(1)用双线桥标出该反应中电子的转移方向和数目:3S +6 KOH = 2K2S+K2SO3+3H2O
(2)该反应的氧化产物是 。
(3)该反应的氧化剂与还原剂的质量比是 。
(4)当消耗0.3 mol S时,则转移的电子数是 。
高锰酸钾溶液在酸性条件下可以与硫酸亚铁反应,离子方程式如下(未配平):
MnO4-+ Fe2++ H+ = Mn2++ Fe3++ H2O。下列说法正确的是
| A.MnO4-是氧化剂,Fe3+是还原产物 |
| B.Mn2+的还原性强于Fe2+ |
| C.离子方程式中按物质顺序的化学计量数是:1、5、8、1、5、4 |
| D.生成1 mol 水时,转移2.5 mol电子 |
向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的 CO2后,再稀释到100mL。
(1)在 NaOH 溶液中通入一定量的 CO2后,溶液中溶质的可能组成是①NaHCO3 ②Na2CO3 ③NaOH、Na2CO3 ④______________。
(2)在稀释后的溶液中逐滴加入0.1mol/L的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示:
①A曲线表明,原溶液通入CO2后,所得溶质与盐酸反应产生CO2的最大体积是 mL(标准状况)。
②原NaOH溶液的物质的量浓度为_________。