二氧化氯( ClO2)是一种极易爆炸的强氧化性气体,在生产和使用时必须尽量用“隋性”气体进行稀释,并尽可能防止震动和避光。因此,二氧化氯的制备方法一直是科学家长期寻求解决的问题,目前比较理想的方法是用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。已知,ClO2在常温下是一种黄绿色有刺激性气味的气体,其熔点为一59℃,沸点为11.0℃,易溶于水。某学生拟用图1所示装置模拟工业制取并收集ClO2.
(1)A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式: 。A装置必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、 。
(2)B装置必须放在冰水浴中,其原因是 。
(3)反应后在装置C中可得NaClO2溶液。已知(1)NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2.3H2O,在温度高于38℃时析出晶体是NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl;NaClO2的溶解度曲线如图2所示,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:
①减压,55℃蒸发结晶;② ;③ ;④低于60℃干燥;得到成品。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:量取ClO2溶液10 mL,稀释成100 mL试样。
步骤2:量取V1 mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的Ⅺ晶体,摇匀,在暗处静置30 min。
步骤3:以淀粉溶液作指示剂,用c mol∙L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知I2+2S2O32- =2I- +S4O62-)
①若步骤2中未将锥形瓶“在暗处静置30min”,立即进行步骤3,则测定的结果可能(选填“偏大”、“偏小”或“无影响”)。
②上述步骤3中滴定终点的现象是 。
③根据上述步骤可计算出原ClO2溶液的浓度为 g-L一1,(用含字母的代数式表示)。
净水剂液体聚合硫酸铝铁兼具铁盐和铝盐的双重絮凝特性,一般是以铁盐为主,铝盐为辅。现用的铝土矿(其主要成分是Al2O3,含有少量杂质Fe2O3和SiO2,其他杂质忽略不计)来制备该净水剂,其工艺流程如下:
(1)H2SO4浓度的适宜范围是45%~50%,反应的适宜温度是100℃,其目的是: ;Al2O3与H2SO4反应的化学反应方程式是__________。
(2)操作I为:冷却静置、 、洗涤,所得到的溶液I中的金属阳离子有_______(填化学式)。
(3)溶液I中加入绿矾(FeSO4·7H2O)和双氧水的目的是: ,涉及的反应离子方程式为 _ _。
(4)钢材镀铝后,表面形成的致密氧化铝膜能防止钢材腐蚀,请在答题卡中完成钢材镀铝的装置示意图,并作相应标注。
某同学为了验证Fe3+是否能氧化H2SO3生成了SO42–,他用50mL0.1mol/LFeCl3溶液吸收制取SO2气体的尾气,再进行以下实验:
(1)检验吸收液中的SO42–: ,则证明Fe3+能把H2SO3氧化为SO42–。
(2)请配平并完成上述反应中的化学方程式:
2FeCl3+SO2+ =2FeCl2+H2SO4+2HCl,反应中的氧化产物是 (写化学式)。
(3)吸收液中除了含有H+、Cl–、SO42–以外,对其它成份(Fe3+、Fe2+、H2SO3)的可能组合进行探究:
①提出假设。
假设1:溶液中存在Fe3+、Fe2+;
假设2:溶液中存在 ;
假设3:溶液中存在Fe2+ 而不存在H2SO3(二者恰好完全反应)。
②设计方案、进行实验,验证假设。请在表中写出实验步骤以及预期现象和结论(可以不填满)。限选实验试剂和仪器:试管、滴管、0.1moL L-1KMnO4、0.1moL
L-1KMnO4、0.1moL L-1KSCN溶液、品红溶液。
L-1KSCN溶液、品红溶液。
| 实验步骤 |
预期现象和结论 |
| 步骤1:用试管取样品溶液2~3mL,再用滴管取 |
若出现血红色,则假设1成立; (2)若未出现血红色,则假设2或假设3成立。 |
| 步骤2: |
白钨矿的主要成分是CaWO4 ,含有二氧化硅、氧化铁等杂质,工业生产钨流程如下: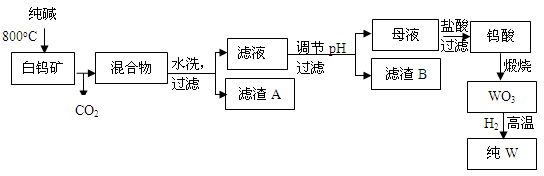
(完全沉淀离子的pH值:SiO32-为8,WO42-为5)
(1)白钨矿反应前需要进行粉碎,其目的是_______________________。CaWO4与纯碱发生的化学反应方程式是_______________________________。
(2)滤渣A的主要成分是(写化学式)_____________,滤渣B的化学式是__________。
(3)调节pH可选用的试剂是:__________。
A.氨水 B.氢氧化钠溶液 C.盐酸
(4)母液中加入盐酸的离子方程式为________________________________________。
(5)白钨矿中CaWO4的质量分数为30%,576千克白钨矿理论上最多能生产钨_____kg。
某研究小组想探究炭与浓硝酸的反应。其实验过程如下。
| 操作 |
现象 |
| a.用干燥洁净的烧杯取约10mL浓硝酸,加热。 |
|
| b.把小块烧红的木炭迅速放入热的浓硝酸中。 |
红热的木炭与热的浓硝酸接触发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧,发出光亮,上下反复跳动。 |
(1)热的浓硝酸与红热的木炭接触会发生多个化学反应。
①炭与浓硝酸的反应,说明浓硝酸具有 性。
②反应产生的热量会使少量浓硝酸受热分解,该反应的化学方程式为 。
(2)实验现象中液面上木炭迅速燃烧,发出光亮。小组同学为了研究助燃气体是O2还是NO2,设计了以下实验。
Ⅰ.制取NO2气体。
①在虚线框内画出用铜与浓硝酸制取和收集NO2的装置简图(夹持仪器略)。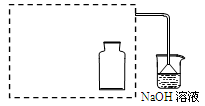
②NaOH溶液的作用是吸收多余的NO2,反应生成两种物质的量相等的正盐,写出反应的的离子方程式 。
Ⅱ.探究实验。
实验操作:在空气中引燃木炭,使其燃烧并带有火焰,将带火焰的木炭伸入盛有NO2气体的集气瓶中。
实验现象:木炭在NO2气体中持续燃烧,火焰迅速变亮,集气瓶中气体颜色变浅直至无色,产生的气体能使澄清石灰水变浑浊,且遇空气不变色。
①根据实验现象写出碳与NO2气体反应的化学方程式 。
②通过实验探究,你认为上表操作b中助燃气体是什么,简述理由 。
软锰矿的主要成分为MnO2,还含有Fe2O3、MgO、Al2O3、CaO等杂质,工业上用软锰矿制取MnSO4·H2O的流程如下: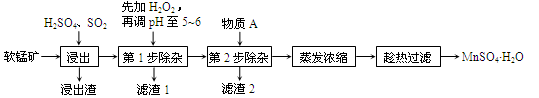
已知:Fe3+、Al3+、Mn2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、10.4、12.4;温度高于27℃时,MnSO4的溶解度随温度的升高而逐渐降低。
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为________。
(2)“浸出”过程中Fe2O3转化为Fe3+和Fe2+,相关反应的离子方程式为________。
(3)“滤渣1”的主要成分是__________,“调pH至5~6”所加的试剂是_________(填“石灰水”或“稀硫酸”)。
(4)根据下表数据,选择“第2步除杂”所加的物质A(由一种阳离子和一种阴离子组成),物质A的化学式为________。
 阴离子 阴离子Ksp  阳离子 |
CO32- |
F- |
OH- |
| Ca2+ |
5.0×10-9 |
1.5×10-10 |
4.7×10-6 |
| Mg2+ |
3.8×10-6 |
7.4×10-11 |
5.6×10-12 |
| Mn2+ |
2.2×10-11 |
5.3×10-3 |
2.1×10-13 |
| Zn2+ |
1.2×10-10 |
3.0×10-2 |
6.9×10-17 |
(5)采用“趁热过滤”操作的原因是________。