氢化锂(LiH)在干燥的空气中能稳定存在,遇水或酸能够引起燃烧。某活动小组准备使用下列装置制备LiH固体。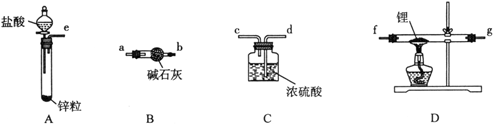
甲同学的实验方案如下:
(1)仪器的组装连接:上述仪器装置接口的连接顺序为____________________,加入药品前首先要进行的实验操作是__________(不必写出具体的操作方法);其中装置B的作用是______________。
(2)添加药品:用镊子从试剂瓶中取出一定量金属锂(固体石蜡密封),然后在甲苯中浸洗数次,该操作的目的是________________________________________,然后快速把锂放入到石英管中。
(3)通入一段时间氢气后加热石英管,在加热D处的石英管之前,必须进行的实验操作________。
(4)加热一段时间后停止加热,继续通氢气冷却,然后取出LiH,装入氮封的瓶里,保存于暗处。采取上述操作的目的是为了避免LiH与空气中的水蒸气接触而发生危险。(反应方程式:LiH + H2O =" LiOH" + H2↑),分析该反应原理,完成LiH与无水乙醇反应的化学方程式______________________________________。
(5)准确称量制得的产品0.174g,在一定条件下与足量水反应后,共收集到气体470.4 mL(已换算成标准状况),则产品中LiH与Li的物质的量之比为____________________。
(6)乙同学对甲的实验方案提出质疑,他认为未反应的H2不能直接排放,所以在最后连接了装置E用来收集H2,请将E装置补充完整。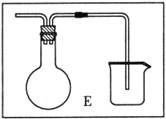
为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究性学习:
【查阅资料】金属活泼性不同,其硝酸盐分解产物不同
(1)K→Na活泼金属的硝酸盐分解生成亚硝酸盐和氧气;
(2)Mg→Cu等较活泼金属的硝酸盐分解生成氧化物、NO2和O2;
(3)Hg以后不活泼金属的硝酸盐分解生成金属、NO2和O2。
2KNO3 2KNO2↑+O2↑ 2Cu(NO3)2
2KNO2↑+O2↑ 2Cu(NO3)2 2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑
2AgNO3 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑
【实验一】探究Fe(NO3)2热分解固体产物中Fe元素的价态。该小组甲同学将其溶于足量的稀H2SO4得到相应两份溶液,进行以下探究实验。
【提出猜想】
猜想一:Fe元素只显+2价;
猜想二:Fe元素只显______价;
猜想三:Fe元素_________。
【实验操作】①向一份溶液中滴入KSCN溶液;②稀酸性KMnO4溶液中滴入另一份溶液。
【实验现象】实验① ;实验② 。
【实验结论】猜想二成立,则Fe(NO3)2分解的化学方程式是 。
【实验二】探究Fe(NO3)2热分解气体产物的性质。小组乙、丙同学进行了如下图所示的实验(收集时操作恰当,几乎没有空气)
实验步骤:①连接仪器;②检查装置气密性;③取一定质量Fe(NO3)2装于大试管,并重新连接好仪器;④加热;⑤……
(1)乙同学使用A装置收集气体,恰好收集到27mL红棕色气体,要从水槽中取出量筒,乙同学的正确操作方法是 。
(2)乙同学用带火星木条检验量筒内气体时,发现木条燃烧,下列判断中正确的是 。
a.气体中只有NO2 b.气体是O2、NO2的混合物
c.支持燃烧的气体只有O2 d.NO2支持燃烧
(3)丙同学取等质量的Fe(NO3)2使用B装置收集气体,可收集到 mL气体。
【实验三】探究固体混合物的成分。小组丁同学取KNO3、Cu(NO3)2、Fe(NO3)2的混合粉末充分加热后用排水法未收集到任何气体,则KNO3、Cu(NO3)2、Fe(NO3)2的物质的量之比可能是()
| A.1:2:2 | B.2:1:3 | C.1:2:3 | D.3:8:6 |
工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是。
(2)另称取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+,若要确认其中的Fe2+,应选用(选填序号)。
a.KSCN溶液和氯水 b.KSCN溶液和铁粉
c.浓氨水 d.酸性KMnO4溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应:
SO2+Br2+2H2O=2HBr+H2SO4,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由此推知气体Y中SO2的体积分数为。
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
(3)装置B中试剂的作用是。
(4)认为气体Y中还含有Q的理由是(用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于(选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是。
(18分)下图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质实验的装置。其中E瓶中放有干燥红色布条;F中为铜网,F右端出气管口附近放有脱脂棉。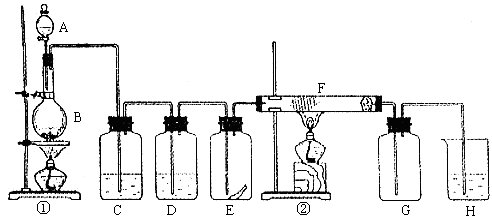
试回答:
(1)A试剂为 ,B试剂为 ,离子方程式为 ;
(2)C试剂为 ;D试剂作用为 ;
(3)E中干燥红色布条 (填“褪色”或“不褪色”);
(4)F管中现象 ,脱脂棉的作用是 ;
(5)H中试剂为 ,离子方程式为 。
氢化钙(CaH2,其中H元素的化合价为 –1价)固体是登山运动员常用的能源提供剂。氢化钙要密封保存,一旦接触到水就发生反应生成氢氧化钙和氢气。氢化钙通常用氢气与金属钙加热制取,下图是模拟制取装置。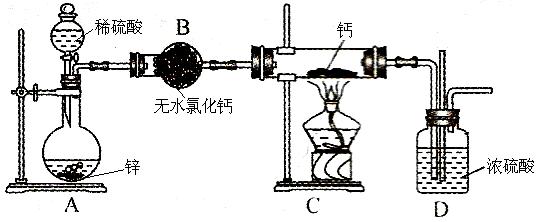
(1)氢化钙与水反应的化学方程式为:__________________。
该反应中氧化产物与还原产物的物质的量之比为:__________________。
(2)利用图示实验装置进行实验,实验步骤如下:检查装置气密性后装入药品;打开分液漏斗活塞,_____________________(请按正确的顺序填入下列步骤的序号)。
①加热反应一段时间②收集气体并检验其纯度
③关闭分液漏斗活塞④停止加热,充分冷却
(3)装置B的作用是:_____________________________________;为了确认进入装置C的氢气已经干燥,应在B、C之间再接一装置,该装置中加入的试剂是:_____________。
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气反应的实验”。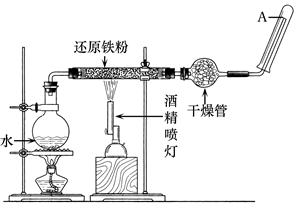
请回答该实验中的问题。
(1)写出该反应的化学方程式。
(2)实验前必须对整套装置进行的操作是 。
(3)圆底烧瓶中盛装的是水,该装置受热后的主要作用是。
(4)干燥管中盛装的物质可以是 ,
作用是。
(5)试管中收集到的气体是,如果要在A处玻璃管口处点燃该气体,则必须对该气体进行,这一操作的目的是