天然气含有硫化氢气体,回收并综合利用硫化氢有重要的经济价值和环境保护意义。如硫化氢可经过一系列反应制得硫酸:
(1)物质发生不完全燃烧时的反应热难以通过实验测得。已知硫化氢气体的燃烧热是586 kJ/mol,固体硫单质的燃烧热是297kJ·mol-1。写出硫化氢气体不完全燃烧生成固体硫单质的热化学方程式 。
(2)工业生产中硫化氢尾气可用NaOH溶液吸收。
①吸收尾气后得到的Na2S溶液显 性(填“酸”、“碱”、“中”);
②下列与H2S、NaHS和Na2S相关的离子方程式正确的是(填字母序号)_________。
| A.H2S+OH—=HS—+H2O | B.HS—+H2O=H2S+OH— |
C.HS—+H2O S2—+H3O+ S2—+H3O+ |
D.S2—+H2O H2S+2OH— H2S+2OH— |
(3)在一定温度下,某容器中发生2H2S(g) 2H2(g)+S2(g)的反应,测得相应时间时部分物质的浓度(mol·L-1)如下表,根据表中数据回答问题:
2H2(g)+S2(g)的反应,测得相应时间时部分物质的浓度(mol·L-1)如下表,根据表中数据回答问题:
 时间 时间物质 |
0 min |
20 min |
60 min |
90 min |
120 min |
| H2S |
|
|
0.006 |
0.005 |
|
| H2 |
0 |
0.002 |
0.004 |
|
|
| S2 |
0 |
|
0.002 |
|
0.0025 |
①判断90 min时反应速率v(正)______v(逆)(填“>”、“=”或“<”);
②求该温度下反应的化学平衡常数(不必写出计算过程)K=______ ___。
(4)以硫化氢为原料,使用质子固体电解质(能传导H+)构成燃料电池,硫化氢放电后生成硫蒸气(化学式S2),该燃料电池的负极反应式为_________ ____。
(5)硫酸是强酸,在图中画出硫酸溶液和氢氧化钠溶液反应过程的能量变化示意图。
金属钛被称为铁和铝之后崛起的第三金属,它是空间技术、航海、化工、医疗上不可缺少的材料。
I、工业上用钛矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得:
其中,步骤②发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。
(1)净化钛矿石时,是否需要除去杂质FeO?答:_________(填“需要”或“不需要”)
(2)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中发生反应的离子方程式。
II、为了提高资源的利用率,减少环境污染,可将氯碱厂、炼钛厂和甲醇厂组成产业链,其关系如下图所示。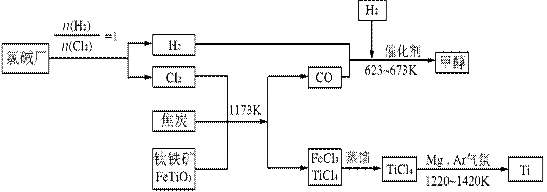
(3)写出钛铁矿经氯化法得到四氯化钛的化学方程式_________________________。
(4)已知:①Mg(s)+Cl2(g)=MgCl2(s);△H=一641 kJ·mol-1
②1/2Ti(s)+Cl2(g)=1/2TiCl4(l);△H=一385 kJ·mol-1
则Mg 与TiCl4反应的热化学方程式为,
该反应在氩气氛中进行的理由是。
(5)在上述产业链中,合成192 t 甲醇理论上需额外补充H2t (不考虑生产过程中物质的任何损失)。
有原子序数依次增大的五种主族元素X、Y、Z、W、R,已知:①X与Z,Y、R与W分别同族;②X、Z、W分别与Y都可组成两种中学常见的化合物;③Y的阴离子与Z的阳离子的核外电子排布相同。根据以上叙述回答问题:
(1)R单质可用作半导体材料,写出该元素名称它与Y元素原子序数差为_____
(2)用电子式表示化合物X2W的形成过程__________________________________。
(3)写出2种均由X、Y、Z、W 4种元素所组成的化合物在水溶液中发生反应的化学方程式_________________。Z、X、W三种元素组成的盐溶于水呈碱性,溶液中离子浓度大小顺序为:______________________________。
(4)X、Y两元素的单质已被应用于宇宙飞船的燃料电池,其结构如图所示。两个电极均由多孔性碳构成,通入的两种单质由孔隙逸出在电极表面放电。b电极上的电极反应式为_______。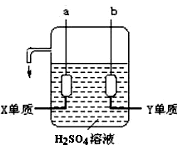
(5)请写出Z元素单质的一种用途_______。
有机化学反应因反应条件不同,可生成不同的有机产品。例如:
(1)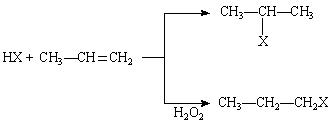 (X为卤素原子)
(X为卤素原子)
(2)苯的同系物与卤素单质混合,若在光照条件下,侧链上氢原子被卤素原子取代;若在催化剂作用下,苯环上的氢原子被卤素原子取代。
工业上利用上述信息,按下列路线合成结构简式为 的物质,该物质是一种香料。
的物质,该物质是一种香料。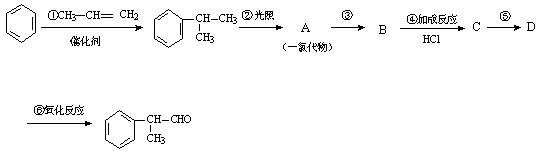
请根据上述路线,回答下列问题:
(1)A的结构简式可能为________________、____________________。
(2)反应①、③、⑤的反应类型分别为________、________、_______。[
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件):
_________________________________________________________。
(4)工业生产中,中间产物A必须经反应③④⑤制得D,而不采取直接将A转化为D,其原因是___________________________________________。
(5)这种香料具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇FeCl3溶液呈紫色②分子中有苯环,且苯环上的一溴代物有两种。写出符合上述条件的物质可能的结构简式(只写两种):
有机物A(C6H8O4)为食品包装纸的常用防腐剂。A可以使溴水褪色。A难溶于水,但在酸性条件下可发生水解反应,得到B(C4H4O4)和甲醇。通常状况下B为无色晶体,能与氢氧化钠溶液发生反应。
(1)A可以发生的反应有(选填序号)。
①加成反应②酯化反应③加聚反应④氧化反应
(2)B分子所含官能团的名称是、
(3)B分子中没有支链,其结构简式是 与B具有相同官能团的同分异构体的结构简式是。
与B具有相同官能团的同分异构体的结构简式是。
(4)由B制取A的化学方程式是。
(5)天门冬氨酸(C4H7NO4)是组成人体蛋白质的氨基酸之一,可由B通过以下反应制取: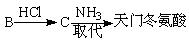
天门冬氨酸的结构简式是。
(1)乙醇的分子结构如右图:
其中①②③④⑤表示化学键的代号,用代号回答:
i乙醇与钠反应断裂的键是_;
ii乙醇与氧气在铜或银作催化剂,加热条件下反应断裂的键是。
(2)把一端弯成螺旋状的铜丝放在酒精灯外焰部分加热,看到铜丝表面变成色,这是因为生成了。趁热将它反复插入盛乙醇的试管中,铜丝表面又变成色,并有气味的物质生成,总反应的化学方程式。