碳和氮的化合物与人类生产、生活密切相关。
(1)C、CO、CO2在实际生产中有如下应用:
a.2C + SiO2 Si + 2CO b.3CO + Fe2O3
Si + 2CO b.3CO + Fe2O3 2Fe + 3CO2
2Fe + 3CO2
c.C + H2O CO + H2 d.CO2 + CH4
CO + H2 d.CO2 + CH4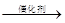 CH3COOH
CH3COOH
上述反应中,理论原子利用率最高的是 。
(2)有机物加氢反应中镍是常用的催化剂。但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,为搞清该方法对催化剂的影响,查得资料:
则:① 不用通入O2氧化的方法除去CO的原因是 。
② SO2(g) + 2CO(g) =" S(s)" + 2CO2(g) △H = 。
(3)汽车尾气中含大量CO和氮氧化物(NO )等有毒气体。
)等有毒气体。
①活性炭处理NO的反应:C(s)+2NO(g) N2(g)+CO2 (g) ∆H=-a kJ·mol-1(a>0)
N2(g)+CO2 (g) ∆H=-a kJ·mol-1(a>0)
若使NO更加有效的转化为无毒尾气排放,以下措施理论上可行的是: 。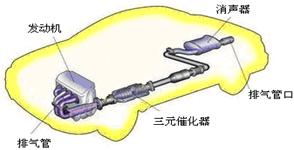

a.增加排气管长度 b.增大尾气排放口
c.添加合适的催化剂 d.升高排气管温度
②在排气管上添加三元催化转化装置,CO能与氮氧化物(NO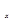 )反应生成无毒尾气,其化学方程式是 。
)反应生成无毒尾气,其化学方程式是 。
(4)利用CO2与H2反应可合成二甲醚(CH3OCH3)。以KOH为电解质溶液,组成二甲醚 空气燃料电池,该电池工作时其负极反应式是 。
(5)电解CO制备CH4和W,工作原理如图所示,生成物W是 ,其原理用电解总离子方程式解释是 。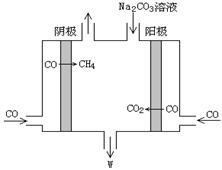
某种烃A的蒸气折合成标况下的密度是3.214g/L,已知该烃的碳氢质量比为5∶1,求:
(1)确定该烃的分子式:__________________:
(2)如果该烃的一氯取代物有4种,写出该烃的结构简式: ___________:
(3)烃A可由另一种烃B通过加成反应而制得,则烃B可能是(任写一种可能的结构简式):
______________________________________________________:
A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应。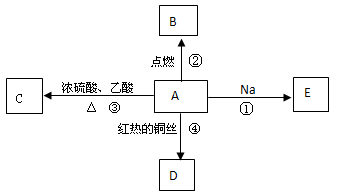
(1)写出A中:①官能团的名称______________②官能团的电子式
(2)下列反应的化学方程式
反应①:
反应④:
(3)反应③的反应类型是_________________。
下面列出了几组物质,请将物质的合适组号填写在空格上。⑴同位素,⑵同素异形体__________;⑶同系物,⑷同分异构体。
①金刚石与“足球烯”C60;②D与T;③16O、17O和18O;
④氧气(O2)与臭氧(O3);⑤CH4和CH3CH2CH3;
⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3); ⑦
⑦ 和
和 ;⑧和
;⑧和 ;
;
冶炼金属常用以下几种方法:①以C、CO或H2做还原剂②以活泼金属Na、Mg等还原③利用铝热反应原理还原④电解法⑤热分解法。下列金属各采用哪种方法还原最佳。(用序号填写下列空白)。
(1)Fe、Zn、Cu等中等活泼金属。
(2)Na、Mg、Al等活泼或较活泼金属。
(3)Hg、Ag等不活泼金属。
(4)V、Cr、Mn、W等高熔点金属。
(8分)主族元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子数的3倍.X、Y和Z分属不同的周期,它们的原子序数之和是W原子序数的5倍.在由元素W、X、Y、Z组成的所有可能的二组分化合物中,由元素W与Y形成的化合物M的熔点最高.(提示:Y是第ⅡA族元素)请回答下列问题:
(1)W元素原子的L层电子排布式为________
(2)X单质与水发生主要反应的化学方程式为___________________
(3)化合物M的化学式为________,其晶体结构与NaCl相同,而熔点高于NaCl.M熔点较高的原因是________________________________________
(4)X、Y、Z可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角,Z处于体心位置,则该晶体的组成为X∶Y∶Z=________;