为应对环境污染,使得对如何减少煤燃烧和汽车尾气中各种含碳、氮、硫等气体的排放,及有效地开发利用碳资源的研究显得更加紧迫。
(1)为减少煤燃烧中废气的排放,常将煤转化为清洁气体燃料。请写出焦炭与水蒸气高温下反应的化学方程式: 。
(2)选择适当的催化剂在高温下可将汽车尾气中的 CO、NO转化为无毒气体。
已知:①2CO(g)+O2(g)=2CO2(g) ∆H1="-566" kJ∙mol-1
②2NO(g)+2CO(g) ⇋N2(g)+ 2CO2(g) ∆H2="-746" kJ∙mol-1
则反应N2(g)+ O2(g)= 2NO(g)的∆H= kJ∙mol-1。
(3)在一定温度下,向1L密闭容器中充入0.5 mol NO、2 mol CO,发生上述反应②,
20s反应达平衡,此时CO的物质的量为1.6 mol。在该温度下反应的平衡常数K= 。
(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应式为_____________________。
(5)氮氧化物进入水体可转化为NO3─,电化学降解法可用于治理水中NO3─的污染。原理如图所示。
电源正极为 (填“A”或“B”),若电解过程中转移了0.4mol电子,则处理掉的NO3─为 g。
工业上常常利用反应①来生产环氧乙烷,但是伴随副反应②。
①C2H4(g)+ O2(g) →
O2(g) →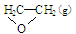 ;△H1②C2H4(g)+3O2(g) → 2CO2(g)+2H2O(g);△H2
;△H1②C2H4(g)+3O2(g) → 2CO2(g)+2H2O(g);△H2
(1)写出环氧乙烷充分燃烧的热化学反应方程式。答:____________________________;
(2)工业生产中,可通过某一措施来加快反应①而对反应②影响较小,从而提高环氧乙烷的生产效率。工业生产采取的这种措施是_______________。
A.升高反应体系的温度B.增大体系中氧气的浓度
C.使用合适的催化剂D.降低反应体系的压强
(3)已知C=C、O=O、C—C键能分别为a kJ·mol-1、b kJ·mol-1、c kJ·mol-1,则环氧乙烷中C—O键能为kJ·mol-1;
(4)反应②可以设计成燃料电池,若以酸做电解质溶液,负极反应式是。
在确定苯的结构的研究过程中,曾经有下列结构:a. 、b.
、b. 。
。
请回答下列问题:
(1)若苯的结构为a,则它与 结构在下列哪些方面不同 (填字母代号)。
结构在下列哪些方面不同 (填字母代号)。
| A.一氯代物的种类 | B.二氯代物的种类 |
| C.与溴水作用 | D.与氢气作用 |
(2)请设计一个实验证明上述b分子的结构简式不能表示苯的结构(要求写出简要的实验步骤)。
写出相应烷烃的分子式:
(1)同温同压下蒸气的密度是H236倍的烷烃 。
(2)分子中含有200个氢原子的烷烃 。
(3)1 L烷烃的蒸气完全燃烧时,生成同温同压下的水蒸气15 L 。
(4)分子中含有22个共价键的烷烃 。
下列各组物质中全属于有机物的是 ;全属于烃的是 。
| A.CH4、C2H5OH、C6H12O6(果糖)、(C6H10O5)n(淀粉) |
| B.C2H2、H2O2、CCl4、C6H6 |
| C.CH4、C2H4、H2CO3、CH3Cl |
| D.CH4、C2H6、C2H2、C6H6 |
将等物质的量的A、B、C、D四种物质混合放入V L密闭容器中,发生如下反应:aA+bB cC(s)+dD,当反应进行到第t min时,测得A减少了n mol,B减少了n/2 mol,C增加了3n/2 mol,D增加了n mol。此时反应达到平衡。
cC(s)+dD,当反应进行到第t min时,测得A减少了n mol,B减少了n/2 mol,C增加了3n/2 mol,D增加了n mol。此时反应达到平衡。
(1)该化学方程式中,各物质的化学计量数分别为:a= ,b= ,c= ,d= 。
(2)以B的浓度变化表示的该化学反应的速率为v(B)= 。