硫酸铜、硝酸铁都是重要的化工原料。
(1)以下是某工厂用含铁的废铜为原料生产胆矾(CuSO4·5H2O)的生产流程示意图:
胆矾和石膏在不同温度下的溶解度(g/100g水)见下表。
| 温度(℃) |
20 |
40 |
60 |
80 |
100 |
| 石膏 |
0.32 |
0.26 |
0.15 |
0.11 |
0.07 |
| 胆矾 |
32 |
44.6 |
61.8 |
83.8 |
114 |
请回答下列问题:
①红褐色滤渣的主要成分是__________;
②写出浸出过程中生成硝酸铜的化学方程式 ;
③操作I的温度应该控制在________左右;
④从溶液中分离出硫酸铜晶体的操作II应为将热溶液_______、______、洗涤、干燥。
(2)某兴趣小组在实验室利用图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行Fe(NO3)3对H2O2分解速率影响的实验。5min后可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是___________________ 。
已知下列数据:
| 物质 |
熔点(℃) |
沸点(℃) |
密度(g/cm3) |
| 乙醇 |
-117.3 |
78.5 |
0.789 |
| 乙酸 |
16.6 |
117.9 |
1.05 |
| 乙酸乙酯 |
-83.6 |
77.5 |
0.90 |
| 浓硫酸(98%) |
- |
338.0 |
1.84 |
学生在实验室制取乙酸乙酯的主要步骤如下:
①在30 mL的大试管A中按体积比1∶4∶4的比例配制浓硫酸、乙醇和乙酸的混合溶液;
②按下图连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10 min;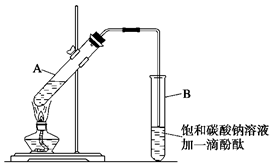
③待试管B收集到一定量的产物后停止加热,撤去试管B并用力振荡,然后静置待分层;
④分离出乙酸乙酯层,洗涤、干燥。
请根据题目要求回答下列问题:
(1)配制该混合溶液的主要操作步骤为____________________________________
写出制取乙酸乙酯的化学方程式: _____________________________________
(2)上述实验中饱和碳酸钠溶液的作用是(填字母)_______________________________。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热操作,其主要理由是____________________________________
(4)指出步骤③所观察到的现象: _______________________________________________
分离出乙酸乙酯后,为了干燥乙酸乙酯可选用的干燥剂为(填字母)__________。
A.P2O5 B.无水Na2SO4C.碱石灰 D.NaOH固体
(5)某化学课外小组设计了如下图所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),与上图装置相比,此装置的主要优点有: __________________________________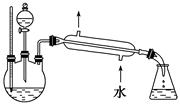
某实验小组用下列装置进行乙醇催化氧化的实验。
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式:________________________________________________________________________
________________________________________________________________________。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明乙醇的催化氧化反应是________反应。
(2)甲和乙两个水浴作用不相同。
甲的作用是________________;乙的作用是__________________________________。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是
________________________________________________________________________。
集气瓶中收集到的气体的主要成分是_____________________________________。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有________。要除去该物质,可先在混合液中加入________(填写字母)。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
然后,再通过________(填实验操作名称)即可除去。
(15分)有机物M(分子式:C6H4S4)是隐形飞机上吸波材料的主要成分。某化学兴趣小组为验证其组成元素,并探究其分子结构进行了下列实验:
(1)验证组成元素
将少量样品放入燃烧管A中,通入足量O2,用电炉加热使其充分燃烧,并将燃烧产物依次通入余下装置。(夹持仪器的装置已略去)
①写出A中样品燃烧的化学方程式:________________________________________。
②装置B的目的是验证有机物中含氢元素,则B中盛装的试剂为________。
③D中盛放的试剂是________(填序号)。
a.NaOH溶液 b.品红溶液 c.酸性KMnO4溶液 d.溴的CCl4溶液 e.饱和石灰水
④能证明有机物含碳元素的现象是_________________________________________。
⑤装置Ⅰ、Ⅱ不能互换的理由是______________________________________________。
⑥燃烧管中放入CuO的作用是________________________________________________。
⑦指出装置F的错误:__________________________________________________。
(2)探究有机物M的分子结构高的对称性,氢原子的环境都相同。将2.04 g该有机物加入溴的CCl4溶液,充分振荡后溶液褪色,并消耗了0.03 mol Br2。
⑧该有机物分子结构中含有的官能团为________(填结构式)。
⑨有机物M的结构简式为________(填序号)。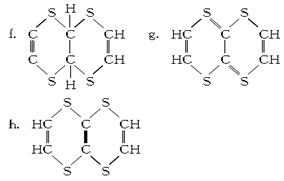
如图所示:在800 mL的大烧杯中放入碎纸屑,把盛有50 mL 0.50 mol·L-1盐酸的200 mL烧杯放到大烧杯中,两只烧杯间填满碎纸屑。用泡沫塑料板做成大烧杯盖,通过盖子插入一根玻璃搅拌器(末端呈半圆环的玻璃棒)和一只温度计,测定溶液的温度。迅速往盐酸溶液中加入50 mL 0.55 mol·L-1烧碱溶液,盖好,搅拌溶液,观察温度的变化。当温度保持稳定时,记录读数,取出装反应液的烧杯,倒出溶液,清洗干净,保持内外杯壁干燥。重复进行三次实验。用这一实验可以粗略测定中和热。
(1)烧杯间填满碎纸屑的作用是_____ 。
(2)要重复进行三次实验的目的是_____ 。
(3)烧杯如不盖硬纸板,求得的中和热数值将_____ (填“偏大”、“偏小”或“无影响”)。
(4)实验中若改用60 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1烧碱溶液进行上述反应,与上述实验相比,所放出的热量_____ (填“相等”或“不相等”),所求中和热_____ (填“相等”或“不相等”),理由是_____。
(5)三次平行操作测得数据中,起始时盐酸与烧碱溶液温度相同,而终止温度与起始温度之差(t2-t1)分别为①2.3 ℃ ②2.4 ℃ ③2.9 ℃,则最终代入计算式的温度差的平均值为_____ ℃。
在一只小烧杯里,加入20 g Ba(OH)2·8H2O粉末,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后加入10 g NH4+Cl晶体,并用玻璃棒迅速搅拌。
(1)实验中玻璃棒的作用是_______。
(2)写出有关反应的化学方程式: _______ ,该反应属_______反应(填基本反应类型)。
(3)实验中观察到的现象有_______ 、 _______且反应混合物成糊状,反应混合物呈糊状的原因是_______ 。
(4)通过_______现象,说明该反应为_______热反应,这是由于反应物的总能量_______生成物的总能量。