有一种瓦斯分析仪能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如下图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。下列有关叙述正确的是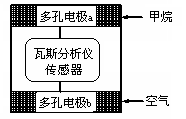
| A.电极a的反应式为:CH4+4O2--8e-=CO2+2H2O |
| B.电极b是正极,O2-由电极a流向电极b |
| C.瓦斯分析仪工作时,电池内电路中电子由电极a流向电极b |
| D.当固体电解质中有1 mol O2-通过时,电子转移4 mol |
下列叙述正确的是()
A.稀硝酸、稀硫酸均能将木炭氧化成二氧化碳
B.Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱
C.Li、C、P分别在足量氧气中燃烧均生成一种相应氧化物
D.NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体
将1.12 g铁粉加入25 mL 2 mol/L氯化铁溶液中充分反应后,结果是( )
| A.铁粉有剩余,溶液呈浅绿色,Cl-基本保持不变 |
| B.往溶液中滴入无色KSCN溶液,溶液变红色 |
| C.Fe2+和Fe3+物质的量之比为5∶1 |
| D.氧化产物和还原产物的物质的量之比为2∶ 5 |
下列有关化学用语使用正确的是()
在实验室不宜长期保存,必须现用现配的是()
①溴水②银氨溶液③石灰水④氯水⑤氢硫酸
⑥NaOH溶液⑦FeSO4溶液⑧FeCl3溶液⑨CuSO4溶液⑩醋酸
| A.②③④⑧⑨ | B.⑤⑦⑧⑨⑩ | C.②③④⑤⑦ | D.①⑥⑧ |
Na2O2、Cl2、SO2等均能使品红溶液褪色。下列说法正确的是()
| A.Na2O2、Cl2、SO2依次属于电解质、单质、非电解质 |
| B.标准状况下,1 mol Na2O2和22.4LSO2反应,转移电子数目为NA |
| C.等物质的量Cl2和SO2同时通入品红溶液,褪色更快 |
| D.在Na2O2中阴阳离子所含的电子数目相等 |