(12分)(1)已知下列反应的热化学方程式为: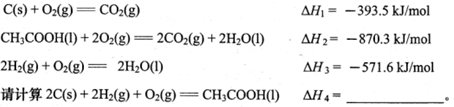
(2)某可逆反应在不同条件下的反应历程分别为A、B,如图所示。
①据图判断该反应是_______(填“吸”或“放”)热反应,当反应达到平衡后,其他条件不变,降低温度,反应物的转化率_______(填“增大”、“减小”或“不变”);
②其中B历程农明此反应采用的条件为__________(选填序号)。
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用催化剂
(3)一定温度下,在3L容积可变的密闭容器中发生反应H2(g)+CO2(g) 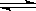 H2O (g)+CO(S),已知c(CO)与反应时间t变化曲线I如图所示,
H2O (g)+CO(S),已知c(CO)与反应时间t变化曲线I如图所示,
若在t0时刻分别改变一个条件,曲线I变为曲线II和曲线III。 当曲线I变为曲线II时,改变的条件是_______________。当曲线I变为曲线III时,改变的条件是________.
(4)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将0.2 mol/L的乙酸与0.1 mol/LNaOH溶液等体积混合后溶液显酸性,则混合溶液中离子浓度由大到小的顺序为_________________________。
化学实验是学习化学的基础,要通过实验去学习化学。
(1)下列关于实验的叙述中正确的有________。
| A.不慎碰翻燃着的酒精灯使酒精在桌面上燃烧起来,应立即用湿抺布灭火 |
| B.不慎将酸沾到皮肤或衣物上,应立即用浓NaOH溶液清洗 |
| C.用托盘天平称量物品质量时,物品应置于右盘 |
| D.实验时应节约药品,实验剩余的药品应放回原试剂瓶 |
E.可燃性气体点燃前一定要验纯
F.使用分液漏斗前必须检查其是否漏水
(2)请将下列错误实验操作可能会引起的不良后果填在表格中。
| 实验 |
向试管中加锌粒 |
对量筒中液体读数 |
浓硫酸的稀释 |
| 错误操作 |
 |
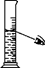 |
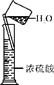 |
| 不良后果 |
如图,有甲、乙两容器,甲体积可变压强不变,乙保持体积不变。向两容器中分别充入1molA、3molB,此时两容器体积均为500mL,温度为T℃。保持温度不变发生反应:A(g)+3B(g)  2C(g)+D(s) ΔH<0
2C(g)+D(s) ΔH<0
(1)下列选项中,能表明甲和乙容器中反应一定达到平衡状态的是 。
A.混合气体的总质量不随时间改变
B.2 v正(C) = 3v逆(B)
C.A、B转化率相等
D.物质D的质量不随时间改变
(2)2min后甲容器中反应达到平衡,测得C的浓度为2mol/L,此时甲容器的体积为_______mL。
(3)当甲乙两容器中反应都达平衡时,甲和乙中B的转化率α甲(B) _________α乙(B)。(填“>”“<”或“=”)
(4)其它条件不变,甲中如果从逆反应方向开始反应建立平衡,要求平衡时C的物质的量与(2)中平衡时C的物质的量相等,则需要加入C的物质的量n(C)=________mol,加入D的物质的量n(D)应该满足的条件为______________。
有A、B、C三瓶失去标签的无色溶液:K2CO3、BaCl2、Na2SO4。将它们分别与H2SO4作用,A产生白色沉淀,B产生无色气体,C中无明显现象。则A的名称是______,B的名称是______, C的化学式为______。反应的化学方程式分别为: , 。
(1)相同物质的量的O2和O3的质量比________,分子个数比为_______,所含氧原子的个数比为_____。
(2)在200 mL 2 mol·L-1MgCl2溶液中,溶质的质量为______。此溶液中Mg2+的物质的量浓度为________,Cl-的物质的量浓度为___________________。
I、现有Ag某气体,它由双原子分子构成,它的摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体所含原子的个数为________ ________个。
(2)该气体在标准状况下的密度为_______________ g/L。
(3)该气体溶于水后形成V L溶液,其溶液的物质的量浓度为________________mol/L。
II、(1)已知食盐常加入KIO3来补充碘元素,检验食盐中是否加碘,可利用如下反应:
KIO3 + 5KI + 3H2SO4 ="=" 3K2SO4 + 3I2 + 3H2O
如果反应中转移0.2mol电子,则生成I2的物质的量为_________________mol。
(2)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染。化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气)。若反应中消耗Cl2 1.5 mol,则被氧化的NH3在标准状况下的体积为______ L。