C、O、Na、Al、S、Cl是常见的六种元素。
(1)C元素位于元素周期表第 周期,第 族;C元素的一种中子数为8同位素的符号为 。
(2)用“大于”“小于”或“等于”填空
| 离子半径 |
酸性 |
还原性 |
得电子能力 |
| N3- Al3+ |
H2SO4 HClO4 |
O2- S2- |
35Cl 37Cl |
(3)①CaCO3和适量HCl溶液反应时,每产生4.4 g 气体(不考虑气体溶解),放热a kJ,则该反应的热化学方程式为 。
②上述反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得pH变化曲线如图所示。
请用离子方程式表示B-C段发生的反应: 。
(4)氢气、氧气常用来作燃料电池,写出电解质为氢氧化钠溶液时负极上的电极方程式 。
已知:①R— —
—
②苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。
以下是用苯作原料制备一系列化合物的转化关系图:
(1)A转化为B的化学方程式是_______________________________________。
(2)图中“苯→①→②”省略了反应条件,请写出①、②物质的结构简式:
①________________________,②____________________________。
(3)B在苯环上的二氯代物有种同分异构体。
(4)有机物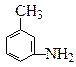 的所有原子(填“在”或“不在”)同一平面上。
的所有原子(填“在”或“不在”)同一平面上。
正盐A能发生下图所示的反应,图中①~⑧分别代表有关反应中的一种物质(某些物质已略去),其中①、②、④、⑤为无色气体。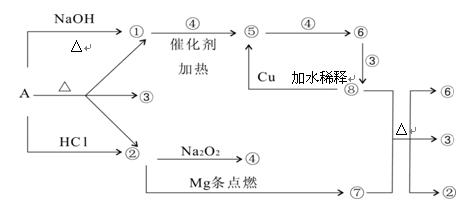
请完成下列各题:
(1)写出化学式A ⑥ ⑦
(2)写出下列反应方程式:
⑧+⑦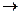 ②+③+⑥:
②+③+⑥:
①+④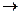 ⑤:
⑤:
(3)⑧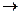 ⑤的离子方程式为:
⑤的离子方程式为:
把正确答案序号填写在题中的横线上
以上属于下列种类的是:
(1)芳香烃:;(2)卤代烃:;(3)醇:;
(4)酚:;(5)醛:
恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:
N2 (g) + 3 H2(g) 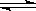 2NH3(g)
2NH3(g)
⑴若反应达平衡时某时刻t时,nt (N2) = 13mol,nt (NH3) = 6mol,计算a的值
⑵反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%。计算平移时NH3的物质的量。
⑶原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始)∶n(平) = 。
⑷原混合气体中,a∶b = 。
⑸达到平衡时,N2和H2的转化率之比,α(N2)∶α (H2)= 。
⑹平衡混合气体中,n(N2)∶n(H2)∶n(NH3) = 。
有两只密闭容器A和B,A容器有一个移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两只容器中分别充入等量的体积比为2∶1的SO2与O2的混和气体,并使A和B容积相等(见下图)在保持400℃的条件下使之发生如下反应: 2SO2+O2 2SO3(气)
2SO3(气) 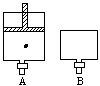
(1)达到平衡时所需的时间A容器比B容器____,A容器中SO2的转化率比B容器_____。
(2)达到(1)所述平衡后,若向两容器中通入等量的氩气,A容器化学平衡___移动,B容器化学平衡____移动
(3)达到(1)所述平衡后,若向两容器中通入等量的原反应气体,达到新平衡时:A容器中SO3的百分含量____(增大、减小、不变。下同),B容器中SO3的百分含量____。