一种新型的乙醇电池,它用磺酸类质子溶剂。电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意如图,下列说法正确的是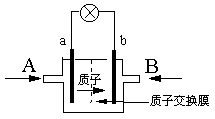
| A.A处通氧气,B处通乙醇 |
| B.电池工作时电流由b极沿导线经灯泡再到a极 |
| C.电池正极的电极反应为:O2+2H2O+4e-=4OH- |
| D.若用这种电池作电源保护金属铁,则a电极连接石墨,b连接铁 |
实验①0.1 mol·L-1AgNO3溶液和0.1 mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀C;②向滤液b中滴加0.1 mol·L-1KI溶液,出现浑浊;③向沉淀C中滴加0.1 mol·L-1KI溶液,沉淀变为黄色。
下列分析不正确的是
A.浊液a中存在沉淀溶解平衡:AgCl(s) Ag+(aq)+C1-(aq) Ag+(aq)+C1-(aq) |
| B.滤液b中不含Ag+ |
| C.③中颜色变化说明AgCl转化为AgI |
| D.实验可以证明AgI比AgCl更难溶 |
下列实验误差分析错误的是
| A.用润湿的pH试纸测稀碱溶液的pH,测定值偏小 |
| B.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 |
| C.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 |
| D.测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度差值偏小 |
0.1 mol·L-1NaOH溶液和0.1 mol·L-1NH4C1溶液等体积混合,离子浓度大小正确的是
| A.c(Na+)>c(C1-)>c(OH-)>c(H+) |
| B.c(Na+)=c(C1-)>c(OH-)>c(H+) |
| C.c(Na+)=c(C1-)>c(H+)>c(OH-) |
| D.c(C1-)>c(Na+)>c(OH-)>c(H+) |
相同体积的pH=3的强酸溶液和弱酸溶液分别跟足量的镁完全反应说法正确的,下列是
| A.弱酸溶液产生较多的氢气 |
| B.强酸溶液产生较多的氢气 |
| C.两者产生等量的氢气 |
| D.无法比较两者产生氢气的量 |
结合下图判断,下列叙述正确的是
| A.I和Ⅱ中正极均被保护 |
| B.I和Ⅱ中负极反应均是Fe-2e-=Fe2+ |
| C.I和Ⅱ中正极反应均是O2+2H2O+4e-=4OH- |
| D.I和Ⅱ中分别加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀 |