硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:
2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2 (该反应△H>0)
某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O实验装置图如下。

(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若 ,则整个装置气密性良好。装置D的作用是____________。装置E中为___________溶液。
(2)装置A中发生反应的化学方程式为_______________________。
(3)①装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 。
a.酸性高锰酸钾溶液 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
②为了使SO2尽可能吸收完全,在不改变C中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是 、 。(写出两条)
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩即可析出Na2S2O3•5H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论: 。
(已知Na2S2O3•5H2O遇酸易分解:S2O32‾+2H+=S↑+SO2↑+H2O;供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液)
(5)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:准确称取a g KIO3固体配成溶液,加入过量KI固体和H2SO4溶液,滴加指示剂,用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL。则c(Na2S2O3)=_________mol·L-1。(只列出算式,不作运算)
(已知:IO3-+5I-+6H+=3I2+3H2O 2S2O32-+I2=S4O62-+2I-)
下面是中学化学实验室中几种常见的玻璃仪器:
①滴瓶 ②容量瓶 ③滴定管 ④烧杯 ⑤圆底烧瓶 ⑦玻璃棒 ⑧移液管
(1)在仪器上具体标明使用温度的是____________(写编号,下同);可作反应容器并可加热的是____________
(2)需要用到温度计的实验是____________
①用乙醇制乙烯 ②石油分馏 ③浓硫酸的稀释 ④测定硝酸钾的溶解度
下列有关实验的叙述中,合理的是。
| A.用pH试纸测得氯水的pH为2 |
| B.电解氯化镁溶液在阴极析出金属镁 |
| C.洗涤沉淀时,向漏斗中加蒸馏水至恰好没过沉淀,搅拌并过滤 |
| D.实验室配制氯化亚铁溶液时,可先将氯化亚铁溶解在盐酸中,再加入蒸馏水稀释,最后加入少量铁屑 |
E.向Na2CO3与NaOH的混合溶液中只需加入酚酞试液,即可确认NaOH的存在
F.用苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出
G.中和滴定实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,须经干燥或润洗后方可使用
(13分)实验室用下列方法测定某水样中O2的含量。
(1)实验原理
用如图所示装置,使溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为。
再用I-将生成的MnO(OH)2再还原为Mn2+,反应的离子方程式为: MnO(OH)2+2I—+4H+=Mn2++I2+3H2O。
然后用Na2S2O3标准溶液滴定生成的I2,反应方程式为: I2+2Na2S2O3=2NaI+Na2S4O6。
(2)实验步骤
①打开止水夹a 和b,从A 处向装置内鼓入过量N2,此操作的目的是;
②用注射器抽取某水样20.00 mL从A 处注入锥形瓶;
③再分别从A 处注入含m mol NaOH溶液及过量的MnSO4 溶液;
④完成上述操作后,关闭a、b,将锥形瓶中溶液充分振荡;
⑤打开止水夹a、b,分别从A 处注人足量NaI溶液及含n mol H2SO4的硫酸溶液;
⑥重复④的操作。
⑦取下锥形瓶,向其中加入2~3滴作指示剂;
⑧用0.005 mol · L—1Na2S2O3滴定至终点。
(3)数据分析
①若滴定过程中消耗的Na2S2O3标准溶液体积为3.90 mL,则此水样中氧(O2)的含量为(单位:mg·L—1)。
②若未用Na2S2O3标准溶液润洗滴定管,则测得水样中O2的含量将(填“偏大”、“偏小”或“不变”)。
③实验要求加入适量的H2SO4使溶液接近中性,其原因是。
某课外活动小组利用如下左图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约lmin后鼓入空气。请填写下列空白: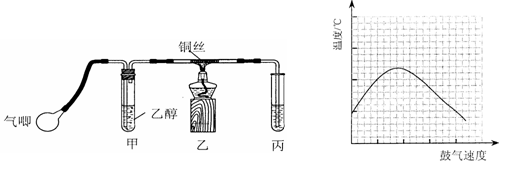
(1)检验乙醛的试剂是;
| A.银氨溶液 | B.碳酸氢钠溶液 | C.新制氢氧化铜悬浊液 | D.氧化铜 |
(2)乙醇发生催化氧化的化学反应方程式为;
(3)实验时,常常将甲装置浸在70℃~80℃的水浴中,目的是 ___ ,由于装置设计上的缺陷,实验进行时可能会 _____。
(4)反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步研究表明,鼓气速度与反应体系的温度关系曲线如上右图所示。
试解释鼓气速度过快,反应体系温度反而下降的原因:,该实验中“鼓气速度”这一变量你认为可用来估量;
(5)该课外活动小组偶然发现向溴水中加入乙醛溶液,溴水褪色。该同学为解释上述现象,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应。请你设计一个简单的实验,探究哪一种猜想正确?
实验制取乙烯时,应将乙醇和浓硫酸快速加热到170℃,在140℃时会生成乙醚,温度过高会使部分乙醇跟浓H2SO4反应生成SO2、CO2、水蒸气。
(1)分别写出乙醇跟浓H2SO4反应生成①脱水生成CH2=CH2;②分子间脱水生成CH3CH2-O-CH2CH3;③SO2、CO2、水蒸气的化学方程式
①;
②;
③;
(2)二氧化硫是大气污染物之一,空
气中的二氧化硫随雨水下降形成酸雨。如下图实验装置,对酸雨的形成进行模拟并验证二氧化硫的部分性质,请回答:
①指出图中仪器a的名称:。
②B装置中淡红色纸花的颜色逐渐变褪去,说明SO2有性。
③反应结束后取出C装置中少量液体,滴加紫色石蕊试液后变色。
④实验完毕后。为了使多余的二氧化硫被充分吸收,C装置应如何改进?
(用文字说明)。