铜工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:

(1)金属M为 ,操作1中需要的主要玻璃仪器是玻璃棒、______、______。
(2)加入新制氯水的的作用是(用离子方程式表示) __________ 。滤渣D的主要成分是 (填化学式)。
(3)充分焙烧的化学方程式为 。如下图所示,焙烧操作中的一处错误是_________。

(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表。则操作2中得到固体C的实验操作是:蒸发浓缩、 ,洗涤、干燥。90℃时Ksp(Li2CO3)的值为 。
| 温度/℃ |
10 |
30 |
60 |
90 |
| 浓度/mol・L-1 |
0.21 |
0.17 |
0.14 |
0.10 |
现有常见金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,
它们之间存在如下转化关系(图中有些反应的产物和反应的条件没有全部标出)。其中B是地壳中含量居第一的金属元素。请回答下列问题: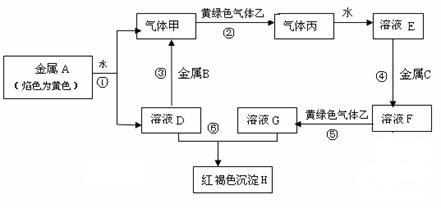
(1)写出金属B和红褐色沉淀H的化学式、。
(2)写出反应①的化学反应方程式。
(3)写出反应⑤的离子方程式。
(6分)氮气其化合物是中学化学的基础知识,请你回答下列含氮化合物的有关问题。
(1)汽车尾气中含有氮氧化物,严重污染大气。NO和NO2是常见的氮氧化物,这两种氮氧化物中,呈红棕色的是;
(2)一氧化氮在常温下很容易与空气中的氧气化合,生成二氧化氮。该反应的化学方程式为:;
(3)实验室常用NH3做“喷泉实验”,该实验说明NH3的溶解性是溶于水(填“极易”或“极难”)。
(8分)下表列出了①~⑥六种元素在元素周期表中的位置。
请回答下列问题:
(1)①、②、③三种元素相比较,非金属性最强的是__ __(填写元素符号);
(2) ②、⑥两种元素的原子半径大小为:② ⑥(填“<”或“>”);;
(3) 元素①的原子结构示意图;
(4)④、⑤两种元素的最高价氧化物对应的水化物在溶液中相互反应的离子方程式是
__________________________。
维生素C又叫抗坏血酸,是一种水溶性维生素。在所有维生素中,维生素C是最不稳定的。在贮藏、加工和烹调时.容易被破坏,它还易被氧化和分解。
(1)维生素C的分子式是;(2)分子中除酯基外,另一含氧官能团的名称是。
(8分)下列三种有机物中:
| A.CH3COOH | B.SiO2 | C.C2H5OH | D.饱和Na2CO3溶液 |
(1)水溶液显酸性且是食醋的主要成分是(填编号,下同)。
(2)制造光导纤维的原材料是___________。
(3)湘西名酒酒鬼酒的主要成分是。
(4)用于除去乙酸乙酯中的乙酸是。