下列离子方程式正确的是
| A.向AlCl3溶液中滴加氨水:Al3++3OH-=Al(OH)3↓ |
| B.FeCl3溶液与Cu的反应:Cu+2Fe3+=Cu2++2Fe2+ |
C.向苯酚溶液中滴加Na2CO3溶液: |
| D.向NaHCO3溶液中加入少量Ca(OH)2溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O |
下列关于反应速率的说法正确的是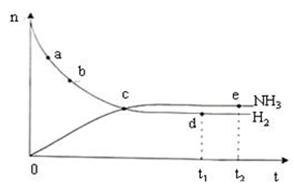
| A.决定反应速率的主要因素是反应物的浓度 |
| B.化学反应速率为0.8 mol /(L·s)是指1s 时某 物质的浓度为0.8mol/L |
| C.用不同物质的浓度变化表示同一时间内、同一 反应的速率时,其数值之比等于反应方程式中对应物质的化学计量数之比 |
D.右上图表示密闭容器中673 K,30 MPa下的反应:N2(g)+3H2(g) 2NH3(g)△H<0, n(NH3)和n(H2)随时间变化的关系曲线图。点d(t1时刻)和点e(t2时刻)处n(N2)不一样 2NH3(g)△H<0, n(NH3)和n(H2)随时间变化的关系曲线图。点d(t1时刻)和点e(t2时刻)处n(N2)不一样 |
能源材料是当今科学研究的热点。氢气作为一种清洁能源,必须解决它的储存问题,C60(结构见下图)可用作储氢材料。继C60后,科学家又合成了Si60、N60,下列有关说法正确的是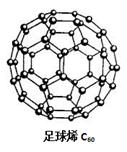
| A.C60、Si60、N60都属于新型化合物 |
| B.C60、Si60、N60互为同分异构体 |
| C.已知N60结构与C60相似,由于N-N键能小于N≡N,故N60的稳定性弱于N2 |
| D.已知金刚石中C-C键长154pm,C60中C-C键长145 ~140pm,故C60熔点高于金刚石 |
根据“绿色化学”的思想,某化学家设计了下列化学反应步骤: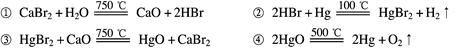
该方案的相关叙述正确的是
| A.该实验的目的是制取HBr | B.该过程的副产品是Hg |
| C.该过程得到的气体只有H2 | D.该过程的本质是水的分解 |
下列离子或物质组能大量共存,且满足相应条件的是
| 选项 |
离子或物质 |
条件 |
| A |
Na+、K+、Cl-、SO42- |
c(Na+)+c(K+)=c(SO42-)+ c(Cl-) |
| B |
Fe3+、SO32-、Cl- |
加入NaOH溶液,产生红褐色沉淀 |
| C |
Ba+、HCO3-、Cl-、H+ |
加入氨水产生沉淀 |
| D |
SO2、O2、NO2 |
通入足量NaOH溶液后,可能会没有任何气体剩余 |
在淀粉—碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝,在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失。下列判断不正确的是
A.氧化性:ClO->I2>SO |
B.漂白粉溶液可使淀粉碘化钾试纸变蓝 |
| C.次氯酸钠可以与亚硫酸钠共存 | D.向氯水中加入亚硫酸钠溶液,氯水褪色 |